Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Термодинамика кислотно-основных равновесий в водных растворахОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Термодинамика кислотно-основных равновесий в водных растворах Термодинамика кислотно-основных равновесий в водных растворах
В табл. 3.4 приведены термодинамические параметры для диссоциации карбоновых кислот, фенолов и сопряженных кислот аминов в водном растворе.
Таблица 3.4
Термодинамические параметры для диссоциации некоторых органических кислот в воде при 25оС
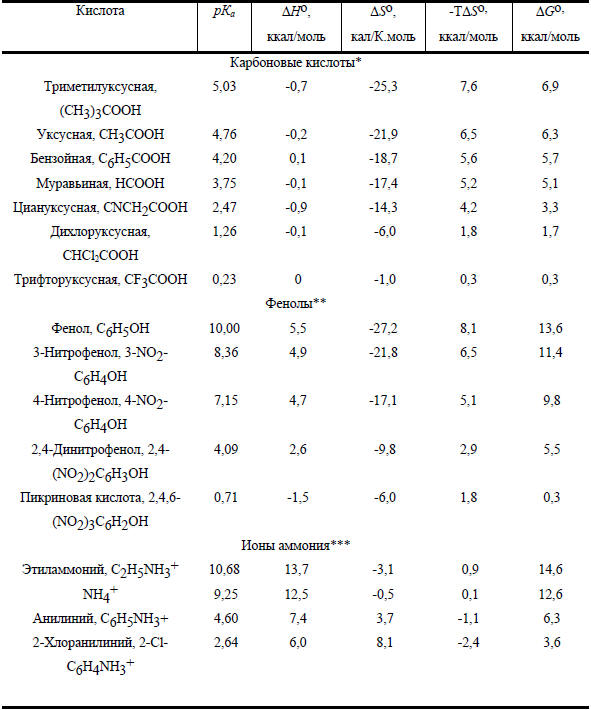
* Данные получены для 26 карбоновых кислот.
** Данные получены для 23 фенолов.
*** Данные получены для 21 анилиниевых и 11 пиридиниевых ионов.
Для карбоновых кислот ΔНо почти одинаковы и очень близки к нулю (т.е. диссоциация термонейтральна). Увеличение кислотности на 5 порядков при переходе от триметилуксусной к трихлоруксусной кислоте, таким образом, целиком связано с энтропийным членом (TΔSo) в главном уравнении термодинамики. Величина ΔSo зависит от того, в какой степени недиссициированная кислота, с одной стороны, и диссоциированные ионы - с другой, нарушают структуру жидкой воды или способствуют ее дальнейшему упорядочиванию (молекулы воды собираются вокруг ионов).
В случае фенолов ситуация иная: для слабых кислот ΔНo>0, но при введении электроноакцепторных заместителей ΔНo становится меньше, а для пикриновой кислоты процесс уже слабо экзотермичен. Одновременно и энтропия становится менее отрицательной. Это связано с тем, что электроноакцепторные заместители, полярные по своей природе, делают молекулу недиссоциированной кислоты более полярной (более похожей на диссоциированные ионы), и поэтому различие между недиссоциированной кислотой и ионами в способности разупорядочивать или упорядочивать структуру воды уменьшается. Уменьшение ΔНo и одновременное увеличение ΔSo в ряду фенолов приводит к тому, что интервал кислотности фенолов значительно больше, чем для карбоновых кислот (≈109 и ≈105 соответственно; см. табл. 3.4).
Совершенно очевидно, что низкая кислотность аммониевых ионов главным образом связана с очень высокими положительными значениями ΔНo. Значения ТΔSo в этом случае невелики и меняются в узком интервале около ТΔSo=0.
Для карбоновых кислоты и фенолов ТΔSo>ΔНo, для протонированных аминов, наоборот, ΔНo>>ТΔSo. Такое различие, по-видимому, связано с зарядовым типом кислоты: карбоновые кислоты и фенолы электрически нейтральны, а соли аммония заряжены положительно. При диссоциации нейтральных кислот число ионов в правой части уравнения на два больше, чем в левой части, а при диссоциации положительно заряженных кислот дополнительные ионы не возникают:
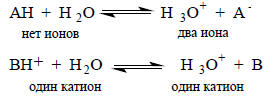
Поскольку ионы (и катион, и анион) сильно удерживают около себя молекулы растворителя, изменение энтропии при диссоциации нейтральных кислот должно быть более отрицательным, чем при диссоциации заряженных кислот, при которой дополнительные ионы не возникают.
Таким образом, изменение кислотности при переходе от одного класса соединений к другому или в серии структурно очень близких соединений может быть связано или только с энтропийными, или только с энтальпийными эффектами, или с обоими эффектами сразу. Поэтому при интерпретации на молекулярном уровне величин рКа в растворах желательно знать величины ΔН и ΔS.
Смотрите также
Оксогидроксид марганца (III) MnO(OH) и его синтез
...
Химия в сельском хозяйстве
Химизация — это одно из направлений научно-технического
прогресса, основанное на широком применении химических веществ, процессов и
методов в различных отраслях, например в сельском хозяй ...
Компьютерные технологии при изучении темы "Молекулярные перегруппировки"
В Государственной
программе развития образования России на 2005-2010 годы отмечается, что в
условиях быстроизменяющегося мира и увеличения потоков информации
фундаментальные предметные знан ...


