Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кислотность и основность в водеОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Кислотность и основность в воде Кислотность и основность в водеСтраница 1
Если воду подвергнуть многократной перегонке в кварцевой или платиновой посуде, то оказывается, что, несмотря на такую тщательную очистку, вода все же сохраняет небольшую, но вполне определенную способность проводить электрический ток. Это обусловлено самоионизацией воды:

Константа равновесия (3.8) при строгой термодинамической записи имеет вид

где - относительная активность частицы Х в равновесной смеси; а- абсолютная активность Х в равновесной смеси и aXотн = aXравн/aX0ХавнраХ0 - абсолютная активность Х в термодинамическом состоянии системы, принятом за стандартное.
Поскольку степень протекания реакции (3.8) очень мала, относительная активность самой воды при равновесии будет очень мало отличаться от единицы (аНОотн21≈), если в качестве стандартного состояния взять гипотетическую чистую неионизированную воду. Кроме того, поскольку равновесие реакции (3.8) очень сильно сдвинуто влево, коэффициенты активность ионов Н3О+ и ОН- в чистой воде будут также близки к единице. Поэтому относительные активность Н3О+ и ОН- фактически равны их молярным концентрациям (если используется молярная шкала и в качестве стандартного состояния выбрана активность 1 моль/л). Отсюда
![где [H3O+] и [OH-] - молярные концентрации; Кавто - константа автопротолиза](images/books/295/index.25.gif) =[H3O+][OH-], Ка0
=[H3O+][OH-], Ка0
где [H3O+] и [OH-] - молярные концентрации; Кавто - константа автопротолиза воды, равная 1,00.10-14 моль2/л2 при 25оС.
Уравнение (3.8) показывает, что в чистой воде [H3O+] = [OH-], поэтому
[H3O+] = [OH-] = 1014− = 10-7 при 25оС.
Для удобства концентрацию гидроксониевых ионов целесообразно приводить в виде отрицательного логарифма, который обозначается символом рН:
рН = -lg[H3O+]
Для чистой воды рН = 7,00, в кислых растворах [H3O+]>[OH-] и рН<7, а в щелочных [H3O+]<[OH-] и рН>7.
Если [H3O+] или [OH-] нельзя считать очень малыми, то молярные концентрации уже не равны активностям, и нужно учитывать активность конкретного вида ионов.
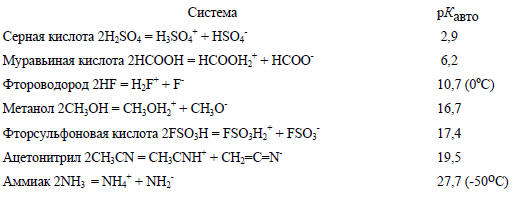
Ниже для сравнения приведены константы автопротолиза некоторых других жидкостей (рКавто = -lg[Кавто] ) при 25оС.
Диссоциацию кислоты АН в воде можно представить уравнением:

В полном виде термодинамическая константа равновесия этой реакции выражается соотношением (ср. (3.9):
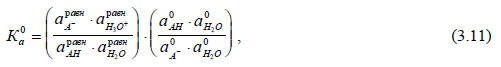
где 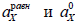 - абсолютные активности частиц Х (Х=А-, Н3О+, АН, Н2О) в равновесной смеси и в стандартном состоянии соответственно.
- абсолютные активности частиц Х (Х=А-, Н3О+, АН, Н2О) в равновесной смеси и в стандартном состоянии соответственно.
Относительная активность воды при состоянии равновесия (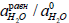 ) не сильно изменяется при переходе от одной кислоты у другой (для разбавленных растворов) и при бесконечном разбавлении приближается к единице. Поэтому можно ввести так называемую термодинамическую константу кислотности К(АН):
) не сильно изменяется при переходе от одной кислоты у другой (для разбавленных растворов) и при бесконечном разбавлении приближается к единице. Поэтому можно ввести так называемую термодинамическую константу кислотности К(АН):
Смотрите также
Физико-химические основы хроматографического процесса
Газовая хроматография — один из
наиболее перспективных физико-химических методов исследования, бурно
развивающийся в настоящее время. Создание и успешная разработка различных
вариантов газо ...
Современные тенденции и новые направления в науке о полимерах
Современные
тенденции и новые направления в науке о полимерах ярко проиллюстрированы в
рамках исследований проведенных Российским Фондом Фундаментальных Исследований
(РФФИ)
В настоящее в ...
Оксираны (эпоксиды)
Оксиранами (старое
название эпоксиды) называют трехчленные циклические соединения, содержащие один
атом кислорода в цикле.
...


