Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кислоты и основания ЛьюисаОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Кислоты и основания Льюиса Кислоты и основания Льюиса
Сила кислот и оснований Льюиса определяется константой равновесия К образования продукта нейтрализации АВ:
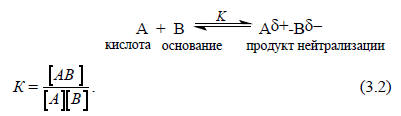
В бренстедовских кислотно-основных реакциях основания всегда координируются с протоном. Если же данная молекула или анион координируется с одной из миллионов возможных кислот Льюиса, то эта молекула или ион уже считаются основанием Льюиса. Таким образом, основность по Бренстеду можно определить как частный случай основности по Льюису, в котором основания образуют связь с протоном.
Кислоты Льюиса можно разделить на классы в зависимости от того, с каким атомом кислоты координируется основание. Например, BF3 можно считать бор-кислотой (В-кислотой), поскольку реагирующее основание образует связь с бором. Когда трет-бутильный катион координируется с хлорид-ионом и дает трет-бутилхлорид, его можно считать С-кислотой. Ион нитрония (NO2+) в большинстве реакций действует как N-кислота и т.д.
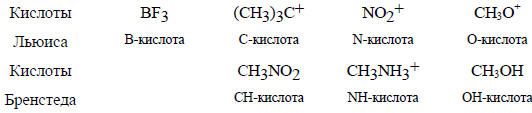
Сила основания В, определяемая константой равновесия в уравнении (3.2), естественно, зависит от природы кислоты А. Это связано с тем, что энергия взаимодействия зависит от относительного положения уровней ВЗМО основания и НСМО кислоты (разд. 2.3.4, гл. 2), а положение этих уровней связано с электроотрицательностью данного элемента. Так, сила основания в реакции с С-кислотами (карбокатионами) называется основностью по углероду, в реакции с BF3 - основностью по бору и т.д. Следует ожидать, что основность, например, по углероду, для данного основания не будет постоянной для всех С-кислот; К в уравнении (3.2) должна, может быть, и в небольшой степени, но все же изменяться при изменении карбокатиона, с которым координируется основание. Следовательно, нужно различать и основность по СН3+, С6Н5+, (С6Н5)3С+, СН3-С+=О и т.д.
Аналогично кислотам, основания Льюиса (и Бренстеда) можно классифицировать как С- (например, CN-), N- или О-основания.
Для органической химии наиболее важное значение имеют С-кислоты, т.е. карбокатионы, и С-основания, т.е. карбанионы. Эти, как правило нестабильные частицы образуются в качестве интермедиатов во многих реакциях и будут подробно рассматриваться в данной и последующих главах.
Смотрите также
Разложение клетчатки микроорганизмами
Еще в
древности при построении деревянных судов для защиты дерева использовали
асфальт. Во времена Римской империи суда обивали металлическими листами. Выбор
материалов производился экспери ...
Медь
29
Cu
1 18 8 2
МЕДЬ
63,546
3d104s1
...
Технология производства полиакрилонитрила
Полимер нитрила акриловой кислоты
(полиакрилонитрил) был впервые получен Моро в 1893 г. из этиленциангидрина и амида акриловой кислоты. Затем в 1931 г. Карозерс разработал метод пол ...


