Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Гиперконъюгация как внутримолекулярное σ,π-возмущениеОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Гиперконъюгация как внутримолекулярное σ,π-возмущение Гиперконъюгация как внутримолекулярное σ,π-возмущение
Метод ВМО позволяет просто объяснить многие химические явления. в том числе и гиперконъюгацию (разд. 2.2.5). Рассмотрим этильный катион СН3СН2+. Согласно классическим электронным представлениям, в этом катионе должен проявляться эффект гиперконъюгации, заключающийся в смещении σ-электронов связи С-Н к катионному центру:
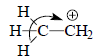
Расположим этильный катион в плоскости σ так, чтобы атомы углерода, а также Н3, Н4 и Н5 находились в этой плоскости, атом Н1 - сверху плоскости, а атом Н2 - снизу (рис. 2.28,а).
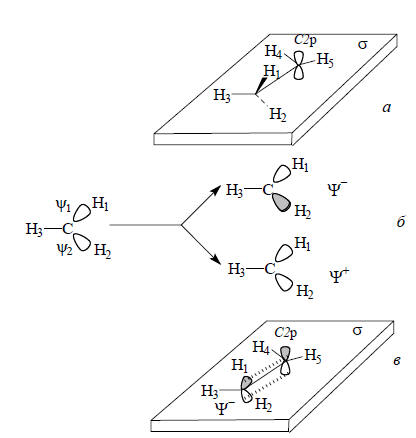 Рис. 2.28. Гиперконъюгация в этильном катионе: а - расположение катиона в плоскости σ; б - образование симметризованных (делокализованных) σ-орбиталей из связывающих орбиталей локализованных σ-связей; в - взаимодействие делокализованной занятой орбитали Ψ- с р-орбиталью соседнего атома углерода.
Рис. 2.28. Гиперконъюгация в этильном катионе: а - расположение катиона в плоскости σ; б - образование симметризованных (делокализованных) σ-орбиталей из связывающих орбиталей локализованных σ-связей; в - взаимодействие делокализованной занятой орбитали Ψ- с р-орбиталью соседнего атома углерода.
Плоскость σ будет плоскостью симметрии ядерного остова катиона, поэтому она должна быть и плоскостью симметрии всех орбиталей. И действительно, σ является плоскостью симметрии С2р и орбиталей σ и σ* связи Н3-С. Однако плоскость σ не будет элементом симметрии орбиталей связей Н1-С и Н2-С, поскольку при отражении в этой плоскости одна орбиталь переходит в другую. Следовательно, орбитали связей Н1-С и Н2-С не получились симметризованными и их необходимо специально симметризовать. Процесс симметризации показан на рис. 2.28,б. В результате возмущения первого порядка вырожденные уровни ψ1 и ψ2 расщепляются на более низкий и более высокий уровни Ψ+ и Ψ-. К орбиталям Ψ+ и Ψ- уже можно применить симметрические преобразования: Ψ+ будет симметричной, а Ψ- - антисимметричной относительно операции σ. Особое значение имеет орбиталь Ψ-. Во-первых, она является высшей занятой орбиталью группы СН3 и поэтому по энергии ближе всех других орбиталей этой группы к пустой С2р-орбитали, являющейся низшей свободной орбиталью катиона. Следовательно, возмущение Ψ- (ВЗМО) - С2р (НСМО) по энергии должно быть эффективным. Во-вторых, симметрия Ψ- и С2р одинакова: обе орбитали антисимметричны относительно плоскости σ и поэтому перекрывание между ними не равно нулю. Орбиталь Ψ- похожа на р-орбиталь: это как бы искаженная р-орбиталь, верхняя и нижняя доли которой отклонены от вертикальной оси вправо на 109,5о-90о=19,5о (рис. 2.28). Таким образом, пустая орбиталь С2р и заполненная орбиталь Ψ- могут взаимно возмущаться, что приведет к понижению энергии новой возмущенной орбитали (Ψ-+С2р), на которой будет находиться пара электронов, до возмущения занимавшая более высокую орбиталь Ψ-.В теории молекулярных орбиталей термина "гиперконъюгация" нет, тем не менее возмущение, показанное на рис. 2.28,в, эквивалентно гиперконъюгации. Метильная группа, связанная с катионным центром, должна понижать энергию катиона, и действительно, по экспериментальным данным катион СН3СН2+ стабильнее, чем СН3+.
Смотрите также
Геометрия молекул. Теория ЛЭП. Элементы стереохимии
Специалисты
по структурному анализу считают этот раздел стереохимии одинаково важным и
увлекательным и для школьника, и для академика. У этого раздела один “большой
недостаток”.
Он
оди ...
Композиционные материалы на основе полибутилентерефталата и его сополимеров
...


