Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Молекулярные орбитали ацетиленаОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Молекулярные орбитали ацетилена Молекулярные орбитали ацетилена
Молекулярные орбитали ацетилена строятся из фрагментов СН, которые имеют пять орбиталей:

Диаграмма образования орбиталей ацетилена из молекулярных орбиталей фрагментов СН приведена на рис. 2.25.
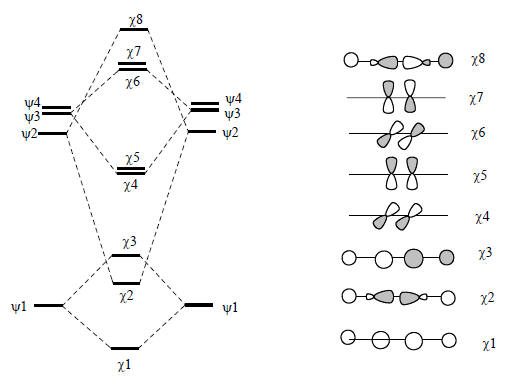 Рис. 2.25. Образование МО ацетилена из фрагментов СН
Рис. 2.25. Образование МО ацетилена из фрагментов СН
Н2С + СН2 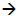 Н2С=СН2 Казалось бы, орбитальные взаимодействия в ходе этой реакции можно представить схемой, приведенной на рис. 2.24. Однако это не так: истинный путь реакции совсем иной.Синглетный метилен :СН2 имеет пустую и дважды занятую молекулярные орбитали. Поскольку электронная пара стремится занять орбиталь с более высоким s-характером, занятой будет орбиталь ψ3, а пустой - орбиталь ψ4. Согласно рис. 2.24, при объединении двух молекул :СН2 происходит взаимодействие ψ3-ψ3 и ψ4-ψ4 :
Н2С=СН2 Казалось бы, орбитальные взаимодействия в ходе этой реакции можно представить схемой, приведенной на рис. 2.24. Однако это не так: истинный путь реакции совсем иной.Синглетный метилен :СН2 имеет пустую и дважды занятую молекулярные орбитали. Поскольку электронная пара стремится занять орбиталь с более высоким s-характером, занятой будет орбиталь ψ3, а пустой - орбиталь ψ4. Согласно рис. 2.24, при объединении двух молекул :СН2 происходит взаимодействие ψ3-ψ3 и ψ4-ψ4 :
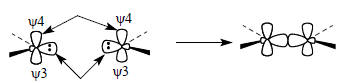
Однако это означает, что между собой взаимодействуют две занятые орбитали - ψ3 и ψ3, что должно приводить к отталкиванию и препятствовать реакции. Предпочтительным является путь, при котором ВЗМО (ψ3) одной частицы :СН2 взаимодействует с НСМО (ψ4) другой частицы:
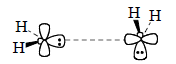
В процессе димеризации группы СН2 постепенно отклоняются из перпендикулярных плоскостей, переходя в одну общую плоскость:
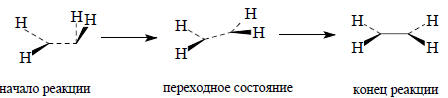
Тем не менее для гипотетического дианиона СН22- и дикатиона СН22+ схема, приведенная на рис. 2.24, приемлема, так как происходит выгодное взаимодейтвие двух занятых граничных орбиталей с незанятыми:
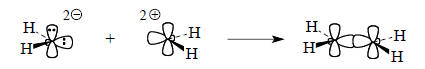
Этот пример показывает, что диаграммы, приведенные на рис. 2.23, 2.24 и 2.25, вовсе не обязательно должно отражать реальные пути реакций. Необходим точный подсчет электронов, заселяющих граничные орбитали, и если получается, что взаимодействуют две пустые и две занятые орбитали, то реакция выбирает путь, отличающийся от приведенного на схемах образования молекул из фрагментов.
Смотрите также
Органические соединения.
Органическими
называются соединения углерода. Простейшими по составу органическими
соединениями являются углеводороды, соединения, в состав которых входят углерод
и водород.
В молекулах
органич ...
Выплавка стали
...
Определение ионов алюминия и меди (II) в сточной воде
Вода-источник
жизни, ничто живое на земле не может обойтись без нее, поэтому ее анализ имеет
важное значение. В сточных водах содержится большее количество разнообразных
органических, неорг ...


