Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Орбитали фрагментов молекул и их использованиеОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Орбитали фрагментов молекул и их использование Орбитали фрагментов молекул и их использованиеСтраница 1
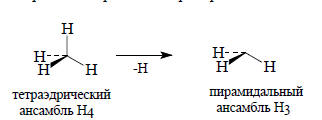
Для построения молекулярных орбиталей этана, этилена, ацетилена и других более крупных молекулы проще всего воспользоваться методом «небольших строительных блоков». В самом деле, этан является соединением двух фрагментов СН3, этилен состоит из двух фрагментов СН2, а ацетилен - из двух фрагментов СН. Пирамидальный ансамбль Н3 получается путем удаления одного из атомов водорода из вершины тетраэдрического ансамбля Н4:
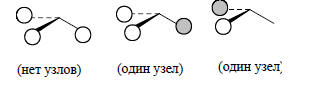
Групповые орбитали Н3, учитывающие элементы симметрии треугольной пирамиды (C3v) имеют такой вид:
Из этих групповых орбиталей, а также из 2s- и 2р-орбиталей атома углерода, помещенного в незанятую вершину треугольной пирамиды Н3, можно построить молекулярные орбитали пирамидального фрагмента СН3 (рис. 2.21). При построении графических изображений молекулярных орбиталей особое внимание следует уделить форме орбиталей ψ2, ψ3 и ψ4.
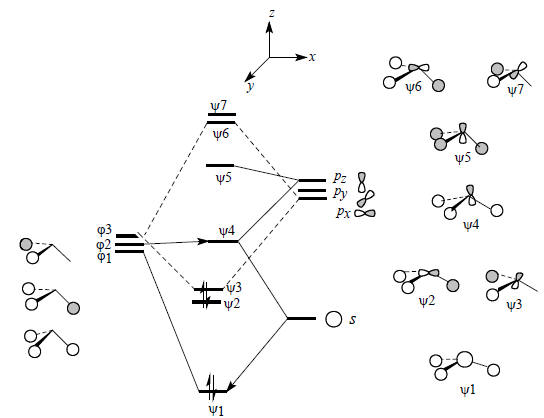 Рис.2.21. Диаграмма орбитального взаимодействия для пирамидального фрагмента CH3.
Рис.2.21. Диаграмма орбитального взаимодействия для пирамидального фрагмента CH3.
В рассматриваемом случае групповая орбиталь ϕ1 испытывает возмущение не только со стороны C2s-орбитали, но и со стороны pz-орбитали атома углерода. Это связано с тем, что вся плотность орбитали ψ1 при образовании пирамидального фрагмента СН3 находится по одну сторону узловой плоскости pz-орбитали, взаимодействие происходит лишь с одной долей этой орбитали и суммарное перекрывание между ψ1 и pz не равно нулю. В отличие от этого, при образовании молекулы метана из Н4 и С аналогичное взаимодействие между ϕ1 и pz будет нулевым:
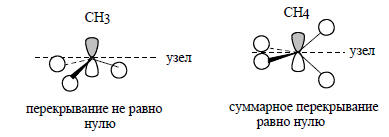
При возмущении второго порядка уровней ϕ1 и s (рис. 2.21) энергия орбитали повышается. С другой стороны, при взаимодействии ϕ1-pz энергия орбитали понижается. Следовательно, новая орбиталь ψ4, которая возникает путем взаимного возмущения орбиталей ϕ1, s и pz, будет иметь среднюю, на очень высокую, но и не очень низкую энергию. Эту орбиталь можно считать несвязывающим уровнем фрагмента СН3 (на самом деле она слабо связывающая, так как перекрывается с 1s-орбиталью атомов водорода в фазе). Ее форма обусловлена комбинацией орбиталей ϕ1, s и pz и определяется на основе следующей схемы:
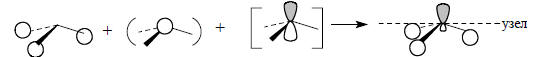
Уже сама форма орбитали свидетельствует о ее несвязывающем характере. Действительно, связывание между С и Н ниже горизонтальной узловой плоскости осуществляется меньшей из двух долей гибридной орбитали углерода, а основная часть орбитали расположена за пределами связей С-Н.Низшая связывающая орбиталь фрагмента СН3 образуется из s-орбитали атома углерода, которая возмущается групповой орбиталью ϕ1 и в меньшей степени (из-за большей разницы в энергии) орбиталью pz:
Смотрите также
Нестехиометрические твердые оксиды - новые vатериалы современной техники
Обычно об
открытиях в химии сообщается в специальных периодических изданиях - научных и
технических журналах. Немногие из этих сообщений попадают в ежедневные газеты,
потому что массовый чи ...
Определение уроновых кислот и полиуронидов
В состав кислых полисахаридов и полиуронидов древесины
входят звенья двух гексуроновых кислот — D-глюкуроновой
и D-галактуроновой. Звенья D-глюкуроновой
кислоты преимущественно содержатся в ...


