Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Молекулярные орбитали HFОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Молекулярные орбитали HF Молекулярные орбитали HFСтраница 1
Молекула HF образуется путем взаимного возмущения орбиталей H1s и валентных орбиталей (2s, 2p) атома фтора подходящей для взаимодействия с симметрии. Для образования связи H-F могут быть использованы только 2s и 2pх-орбитали атома фтора, так как перекрывание 2py- и 2pz-орбиталей атома фтора с 1s -орбиталью атома водорода равно нулю (см. гл. 1, разд. 1.7).
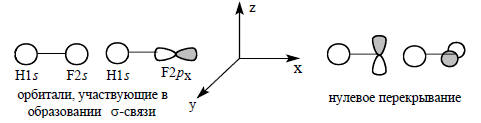
Таким образом, в образовании одной связи H-F должны участвовать три орбитали: H1s, F2s и F2pх.
Из трех невозмущенных орбиталей (АО) должны образовываться три возмущенные орбитали (МО), но связи H-F соответствуют лишь две МО: связывающая и антисвязывающая σ*. Следовательно, третья МО должна носить несвязывающий характер. Получается ситуация, аналогичная рассмотренной выше (разд. 2.4.1) при образовании несвязывающей π-МО аллильной системы.
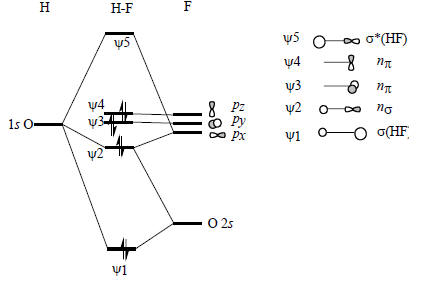 Рис. 2.16. Молекулярные орбитали HF.
Рис. 2.16. Молекулярные орбитали HF.
Диаграмма молекулярных орбиталей H-F приведена на рис. 2.16. Поскольку фтор значительно более электроотрицателен по сравнению с водородом, его валентные АО на диаграмме расположены ниже 1s-орбитали водорода. Самая нижняя связывающая МО ψ1 по энергии ближе всего к F2s-орбитали, поэтому и по форме должна быть похожей на F2s. Она образуется возмущением 2s-орбитали водорода под влиянием 1s-орбитали водорода возмущенной 2рх-орбиталью фтора:
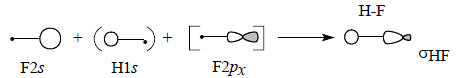
Поскольку ψ1 самая нижняя МО молекулы HF, взаимодействие трех орбиталей происходит в фазе, что отражено знаками «плюс» на приведенной схеме.Перекрывание между двумя s-орбиталями должно превышать перекрывание между s - и р-орбиталями (см. гл. 1, разд. 1.7). Это означает, что главный вклад в энергию вносит взаимодействие F2s-H1s. В первом приближении можно даже пренебречь возмущением со стороны орбитали F2рх (поэтому на схеме эта орбиталь заключена в квадратные скобки) и считать, что ψ1 образуется только из F2s и H1s. Поскольку ψ1 ближе к F2s, чем к H1s, коэффициент, с которым в нее входит F2s, должен превышать коэффициент H1s (поэтому на схеме H1s заключена в круглые скобки). Таким образом, орбиталь ψ1 должна выглядеть примерно так, как показано ниже, что полностью соответствует ее «яйцевидной» форме, полученной с помощью компьютера (см. рис. 1.17):
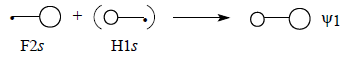
Рассуждая аналогично, можно заключить, что разрыхляющая орбиталь ψ5 в основном принадлежит водороду: Пренебрегая последним членом, получим:
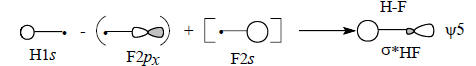
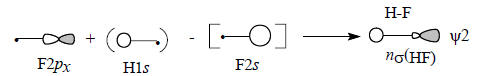
Молекула HF имеет три несвязывающие МО (рис. 2.16). Две из них - это невозмущенные 2рy- и 2рz-орбитали, которые соответствуют «неподеленным электронным парам». Третья орбиталь ψ2 - это орбиталь атома фтора, возмущенная 1s -орбиталью атома водорода с небольшим участием 2s -орбитали атома фтора:
Смотрите также
Разработка методов и средств реабилитации объектов отравляющих веществ
Обеспечение безопасности людей и защита окружающей среды (ОС)
являются основополагающими требованиями Конвенции о запрещении разработки,
производства, накопления и применения химического ору ...
Водородные связи
Интерес к олигомерам фторида водорода (димеру,
тримеру) в последние десятилетия поистине велик. Объясняется это прежде всего
той ролью, которую играет водородная связь при интерпретации, мод ...


