Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Особенности альтернантных углеводородовОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Особенности альтернантных углеводородов Особенности альтернантных углеводородовСтраница 1
Альтернантные системы интересны тем, что их строение и реакционную способность можно очень легко рассчитать.Распределение электронов в четных альтернантных углеводородах. Согласно правилу 4 (раздел 2.4.2), для каждой атомной орбитали сумма квадратов коэффициентов 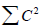 по всем молекулярным орбиталям равна единице, и так как молекулярные орбитали четных АУ располагаются симметрично относительно несвязывающего уровня, связывающие и антисвязывающие парные орбитали (например, ψC2Σ1 и ψ4 или ψ2 и ψ3 в случае бутадиена) должны отличаться не по величине коэффициентов, а только по разному чередованию знаков р-орбиталей. Следовательно, для связывающих орбиталей
по всем молекулярным орбиталям равна единице, и так как молекулярные орбитали четных АУ располагаются симметрично относительно несвязывающего уровня, связывающие и антисвязывающие парные орбитали (например, ψC2Σ1 и ψ4 или ψ2 и ψ3 в случае бутадиена) должны отличаться не по величине коэффициентов, а только по разному чередованию знаков р-орбиталей. Следовательно, для связывающих орбиталей 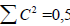 , а поскольку на каждой связывающей орбитали находятся по два электрона, общая π-электронная плотность на каждом атоме (по всем орбиталям) равна единице
, а поскольку на каждой связывающей орбитали находятся по два электрона, общая π-электронная плотность на каждом атоме (по всем орбиталям) равна единице 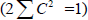 . Таким образом, в четных АУ (этилене, бутадиене, гексатриене, октатетраене, бензоле и т.д.) π-электроны в целом равномерно распределены по сопряженной системе, хотя на каждой индивидуальной орбитали распределение неравномерное.
. Таким образом, в четных АУ (этилене, бутадиене, гексатриене, октатетраене, бензоле и т.д.) π-электроны в целом равномерно распределены по сопряженной системе, хотя на каждой индивидуальной орбитали распределение неравномерное.
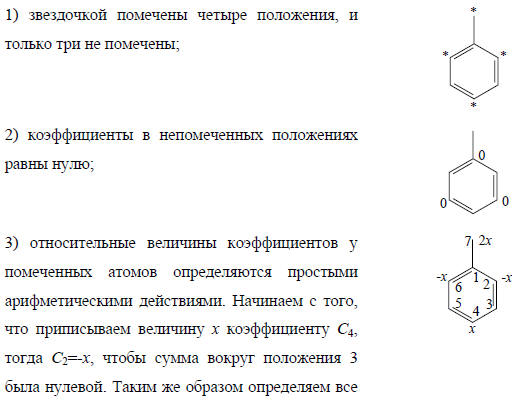
Распределение электронов в нечетных альтернантных системах. Важной особенностью нечетных АУ является наличие несвязывающей молекулярной орбитали (nπ). Для этой орбитали коэффициенты Cn очень просто определить, пользуясь методом Лонге-Хиггинса, развитым Дьюаром. Метод состоит в следующем: 1) расставим звездочки так, чтобы ими было помечено максимальное число атомов; 2) коэффициенты для всех непомеченных атомов должны быть равными нулю (см. орбиталь для аллила; см. рис. 2.6); 3) сумма коэффициентов у всех помеченных звездочкой атомов, окружающих любой непомеченный атом, должна быть равной нулю; 4) для всей обритали 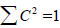 (условие нормировки).Чтобы проиллюстрировать эти правила, рассмотрим бензильную систему (бензильный катион, радикал или анион):
(условие нормировки).Чтобы проиллюстрировать эти правила, рассмотрим бензильную систему (бензильный катион, радикал или анион):

В бензильном радикале на этой орбитали находится один электрон (рис. 2.10) и суммарная (по всем занятым орбиталям) π-электронная плотность на каждом атоме углерода равна единице. Для любого атома сумма коэффициентов по всем орбиталям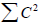 (по связывающим МО) +
(по связывающим МО) +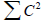 (по разрыхляющим МО) + С2(nπ) = 1. Из условия парности (симметрии расположения МО):
(по разрыхляющим МО) + С2(nπ) = 1. Из условия парности (симметрии расположения МО):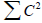 (по связывающим МО) =
(по связывающим МО) =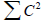 (по разрыхляющим МО). Электронная плотность равна 2
(по разрыхляющим МО). Электронная плотность равна 2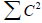 (по связывающим МО) + СC2Σ2(nπ) =1.
(по связывающим МО) + СC2Σ2(nπ) =1.
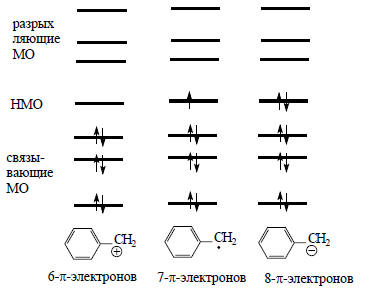 Рис.2.10. π-Орбитали бензильной системы.
Рис.2.10. π-Орбитали бензильной системы.
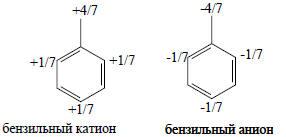
При ионизации бензильного радикала путем отнятия одного электрона получается катион, в котором отсутствует электрон, в радикале находившийся на nπ, т.е. nπ имеет положительную «дырку» (рис. 2.10). Эта «дырка» распределена по молекуле, и поскольку связывающие орбитали остаются заполненными, распределение положительного заряда согласуется с величиной Сn2 на каждом атоме. Аналогично, в бензильном анионе, в котором на nπ имеется второй электрон, отрицательный заряд распределен в соответствии с квадратами коэффициентов, учитывающих вклад каждого атома в несвязывающую орбиталь:
Смотрите также
Новые научные направления современной химии и их прикладное использование
Химия
- наука социальная. Её высшая цель – удовлетворять нужды каждого человека и
всего общества. Многие надежды человечества обращены к химии. Молекулярная
биология, генная инженерия и би ...
Метод суспензионной полимеризации винилхлорида
Термопластичный
полимер поливинилхлорид (ПВХ) – твердое вещество белого цвета, являющееся
продуктом полимеризации винилхлорида, выпускается в виде сыпучего порошка,
готового для дальнейшей ...
Получение и изучение сульфатов микрокристаллической целлюлозы древесины осины
Сложные эфиры
целлюлозы имеют широкое применение для производства, этим объяснятся большое
количество работ посвященных всестороннему изучению эфиров целлюлозы.
Сернокислые эфиры
(сульфа ...


