Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Альтернантные углеводородыОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Альтернантные углеводороды Альтернантные углеводороды
Расчет энергий молекулярных орбиталей, например, по методу Хюккеля, в случае больших молекул является очень утомительным процессом, так как приходится решать обширные детерминанты. Обычно для решения больших детерминантов используют ЭВМ или размер детерминантов уменьшают, применяя методы математической теории групп. Но есть и другие пути.
Богатую информацию о молекулярных орбиталях можно получить, подсчитав число и проанализировав расположение атомов в молекуле. Как уже говорилось выше, энергия МО прямо связана с числом узлов в данной МО, т.е. с взаимным расположением положительных и отрицательных долей атомных орбиталей. Чтобы оценить относительную энергию МО, необходимо подсчитать число узлов. Например, в аллильной системе нижняя π-орбиталь не имеет узлов, следующая имеет один узел, а третья - два узла (рис. 2.9). Относительную энергию этих МО легко определить, если подсчитать и суммировать число связывающих (+) и разрыхляющих (-) взаимодействий между соседними АО. Для аллильной системы нижняя орбиталь имеет два связывающих взаимодействия, средняя не имеет ни связывающих, ни разрыхляющих взаимодействий, а верхняя орбиталь имеет два антисвязывающих взаимодействия:
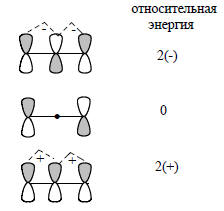
Циклические сопряженные углеводороды имеют вырожденные МО (см. рис. 2.7), возникающие вследствие того, что узлы могут проходить через цикл двумя разными путями, и в результате получаются две орбитали с одинаковой суммой связывающих и несвязывающих взаимодействий. Например, бензол (см. гл. 12) имеет нижнюю связывающую орбиталь с энергией 6(+), две вырожденные связывающие МО с энергией 2(+), две вырожденные антисвязывающие МО с энергией 2(-) и верхнюю антисвязывающую МО с энергией 6(-).Расчеты молекулярных орбиталей можно еще более упростить, если рассмотреть свойства класса соединений, известного под названием альтернантные углеводороды (АУ). Альтернантные углеводороды определяются как любые плоские сопряженные углеводороды, в которых атомы углерода можно поделить на помеченные (звездочкой) и непомеченные таким образом, что два помеченных или два непомеченных атома не будут находиться по соседству друг с другом. Ниже приведены примеры альтернантных и неальтернантных углеводородов:
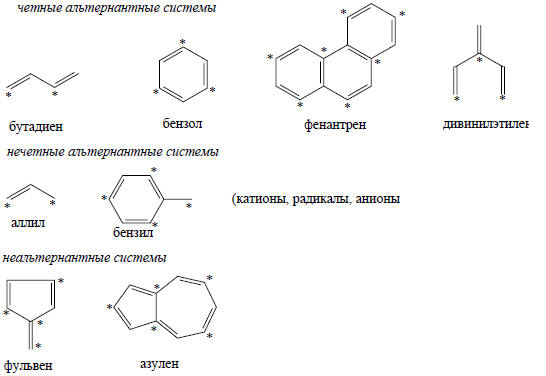
Неальтернантные углеводороды содержат циклы с нечетным числом атомов углерода.
Смотрите также
Физико-химические методы исследования бетонных образцов
С
28 июня по 24 июля 2010 года я проходил практику в Дальневосточном научно - исследовательском
институте строительных материалов Российской академии архитектуры и
строительства Центре &quo ...
Термогравиметрия
Метод термического
анализа, основанный на непрерывной регистрации изменения массы (взвешивании)
образца в зависимости от его температуры в условиях программированного
изменения температуры среды. П ...
Значение химии в создании новых материалов, красителей и волокон
...


