Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Графическое построение π-орбиталейОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Графическое построение π-орбиталей Графическое построение π-орбиталейСтраница 2
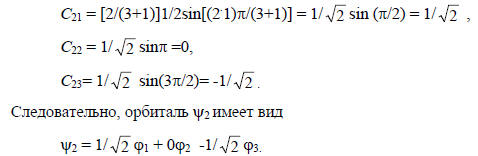
Это означает, что орбитали ϕ1 и ϕ3 входят в ψ2 с коэффициентами, одинаковыми по величине, но противоположными по знакам, а вклад р-орбитали ϕ2 в ψ2 равен нулю, т.е. на центральном атоме углерода нет орбитали ϕ2. Центральный атом углерода в орбитали является узловым; через него проходит зеркальная плоскость симметрии, при отражении в которой волновая функция меняет знак.Проведя аналогичные расчеты для ψ1 и ψ3 , получим (ср. рис. 2.6, б):

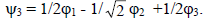
Нижняя орбиталь ψ1 не имеет узлов, а затем число узлов возрастает на один при переходе к следующей, более высокой орбитали. Орбиталь ψ1 симметрична относительно зеркальной плоскости (σ), проходящей через середину полиеновой цепи (через центральный атом углерода), вторая орбиталь ψ2 антисимметрична относительно σ, а третья орбиталь ψ3 опять симметрична.Циклопропенильную π-систему можно рассматривать как результат взаимодействия одиночной р-АО одновременно по обоим концам π-орбиталей этиленового типа. Взаимодействие возможно только со связывающей π-МО, так как разрыхляющая орбиталь по симметрии не подходит под пару р-орбитали.Следовательно, π*-орбиталь не будет возмущаться (рис. 2.7).
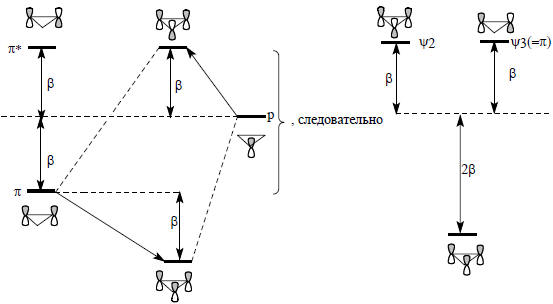 Рис. 2.7. π-Орбитали циклопропенильного типа
Рис. 2.7. π-Орбитали циклопропенильного типа
Энергия этого возмущения определяется по уравнению, аналогичному (2.9), без члена, учитывающего взаимодействие зарядов (так как молекула этилена неполярна):
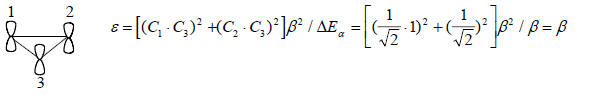
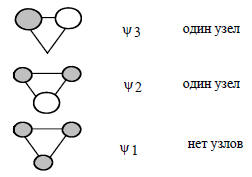
Это означает, что энергия π-орбитали этилена понижается на 2β, а энергия π*-орбитали повышается на β, т.е. относительно несвязывающего уровня орбиталь ψ1 лежит на 2β ниже, а орбиталь ψ2 - на 1β выше (рис. 2.7). Электронная пара на ψ1 орбитали имеет, следовательно, энергию на 4β ниже, чем она была бы на чистой р-орбитали, и на 2β ниже, чем если бы она была на этиленовой π-орбитали. Циклопропенильный катион должен быть стабильнее открытого аллильного катиона на величину β (ср. рис. 2.6 и 2.7).Орбитали ψ2 и ψ3 циклопропенильной π-системы вырождены, и по энергии не отличаются от разрыхляющей π*-орбитали изолированной двойной связи (рис. 2.7). Циклопропенильный радикал, который имеет три π-электрона, по π-электронной энергии не отличается от аллильного радикала, а четырехэлектронный циклопропенильный анион на менее стабилен, чем аллильный катион. Повышенная стабильность циклопропенильного катиона соответствует его ароматическому характеру (гл. 12). Циклопропенильный анион антиароматичен и нестабилен. Если бы он существовал, то представлял бы собой бирадикал, в котором два из четырех π-электронов занимают по одному вырожденные орбитали и имеют параллельную ориентацию спинов (правило Хунда; см. гл. 1).Орбитали циклопропенильной системы, рассчитанные по методу Хюккеля, имеют следующий вид:
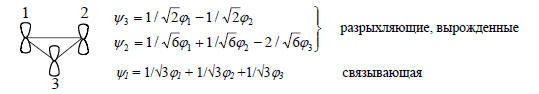
Нижняя орбиталь не имеет узлов, а две верхние имеют по одному узлу. Поскольку π-электронная система циклическая, узловые поверхности проходят через центр описанной окружности. На приведенных ниже диаграммах показаны проекции р-орбиталей на плоскость трехчленного цикла:
1,3-Бутадиен и 1,3-циклобутадиен представляют собой более протяженные сопряженные π-системы, содержащие четыре атомные р-орбитали. Бутадиеновые π-орбитали можно построить из двух этиленовых фрагментов, каждый из которых имеет две орбитали: π и π*. В данном случае необходимо учесть все четыре взаимных возмущения. Взаимодействие между двумя связывающими орбиталями является возмущением первого порядка и дает орбитали ψ1 и ψ2, образующиеся по правилу 1 (разд. 2.3.4). Такое же взаимодействие между разрыхляющими орбиталями дает орбитали ψ3 и ψ4 (рис. 2.8,а). Изменения энергии, которыми сопровождается это возмущение, можно вычислить по уравнению ε=α±CxCyβ (ср. уравнение (2.6)), где 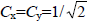 - коэффициенты, с которыми атомные р-орбитали входят в π-МО этиленовых фрагментов (ср. рис. 2.5). Таким образом, ε=1/2β. Однако при таком взаимодействии общая энергия четырех π-связывающих электронов не меняется, так как понижение энергии при образовании ψ1 компенсируется повышением энергии при образовании ψ2. Если же принять вî внимание и перекрывание, то рассматриваемое возмущение первого порядка приведет даже к повышению общей энергии (разд. 2.3.5).Понижение энергии бутадиена по сравнению с энергией двух изолированных этиленовых фрагментов обеспечивается смешиванием связывающей орбитали ψ1 бутадиена с антисвязывающе орбиталью ψ3, а также связывающей орбитали ψ2 с антисвязывающей орбиталью ψ4.Взаимодействие связывающих и разрыхляющих орбиталей является возмущением второго порядка (рис. 2.8,б). Его обычно рассматривают как добавочное возмущение орбиталей, уже образовавшихся при возмущении первого порядка (рис. 2.8,а). Орбитали с разной симметрией не могут смешиваться друг с другом. Например, если бы орбиталь ψ1 взаимодействовала с орбиталью ψ4, то перекрывание в фазе орбиталей на атомах углерода 1 и 3, происходящее при наложении одной орбитали на другую, целиком уничтожилось бы перекрыванием в противофазе орбиталей на атомах 2 и 4. Однако орбитали ψ1 и ψ3, которые обе симметричны относительно центра молекулы (т.е. относительно операции симметрии, которая называется инверсией и обозначается буквой i), могут смешиваться друг с другом. То же относится и к орбиталям ψ2 и ψ4, которые обе антисимметричны относительно операции i и, следовательно, могут смешиваться.Величина этого возмущения второго порядка ε=(CxCyβ)2/ΔE (уравнение (2.8), ΔE=2β, см. рис. 2.5) составляет только ε=18β. Однако такое возмущение второго порядка понижает энергию всех четырех связывающих π-электронов, и, следовательно, делокализованная четырехэлектронная π-система бутадиена стабильнее двух изолированных π-связей на 4ε=12β.
- коэффициенты, с которыми атомные р-орбитали входят в π-МО этиленовых фрагментов (ср. рис. 2.5). Таким образом, ε=1/2β. Однако при таком взаимодействии общая энергия четырех π-связывающих электронов не меняется, так как понижение энергии при образовании ψ1 компенсируется повышением энергии при образовании ψ2. Если же принять вî внимание и перекрывание, то рассматриваемое возмущение первого порядка приведет даже к повышению общей энергии (разд. 2.3.5).Понижение энергии бутадиена по сравнению с энергией двух изолированных этиленовых фрагментов обеспечивается смешиванием связывающей орбитали ψ1 бутадиена с антисвязывающе орбиталью ψ3, а также связывающей орбитали ψ2 с антисвязывающей орбиталью ψ4.Взаимодействие связывающих и разрыхляющих орбиталей является возмущением второго порядка (рис. 2.8,б). Его обычно рассматривают как добавочное возмущение орбиталей, уже образовавшихся при возмущении первого порядка (рис. 2.8,а). Орбитали с разной симметрией не могут смешиваться друг с другом. Например, если бы орбиталь ψ1 взаимодействовала с орбиталью ψ4, то перекрывание в фазе орбиталей на атомах углерода 1 и 3, происходящее при наложении одной орбитали на другую, целиком уничтожилось бы перекрыванием в противофазе орбиталей на атомах 2 и 4. Однако орбитали ψ1 и ψ3, которые обе симметричны относительно центра молекулы (т.е. относительно операции симметрии, которая называется инверсией и обозначается буквой i), могут смешиваться друг с другом. То же относится и к орбиталям ψ2 и ψ4, которые обе антисимметричны относительно операции i и, следовательно, могут смешиваться.Величина этого возмущения второго порядка ε=(CxCyβ)2/ΔE (уравнение (2.8), ΔE=2β, см. рис. 2.5) составляет только ε=18β. Однако такое возмущение второго порядка понижает энергию всех четырех связывающих π-электронов, и, следовательно, делокализованная четырехэлектронная π-система бутадиена стабильнее двух изолированных π-связей на 4ε=12β.
Смотрите также
Газовая хроматография и ее применение в аналитической химии
Хроматография – это
обширная область физико-химических методов анализа, которая занимается
разработкой методов разделения сложных по составу многокомпонентных смесей.
Характерными
особен ...
Адгезионное взаимодействие наночастиц
...
Ацетаты и ацетатные комплексы d-элементов 6 и 7 групп
Рассматриваемые
соединения – ацетаты и ацетатные комплексы элементов шестой и седьмой побочных
подгрупп. К комплексным соединениям относятся кластеры Cr+2, Mo+2,
Re+3, Tc+3. Данные элементы ...


