Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Теория смещения электронных парОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Теория смещения электронных пар Теория смещения электронных пар
В предыдущей главе, рассматривая молекулярные орбитали простейших двухатомных молекул, мы обратили внимание на существенное различие между неполярными гомоядерными молекулами А-А (например, H2, N2, O2), и полярными гетероядерными молекулами типа Аδ+-Вδ- (например, HF, HCl и т.д.). Это различие состояло в том, что занятые (связывающие) МО полярных молекул Аδ+-Вδ- сконцентрированы главным образом на более электроотрицательном атоме В, а на менее электроотрицательном атоме А плотность занятых орбиталей меньше. Орбитали неполярных молекул А-А имеют симметричный вид, т.е. их плотность на правом и левом атомах А одинакова. Это относится как к σ-, так и к π-орбиталям.Можно, следовательно, утверждать, что пара электронов, образующая связь, в полярной молекуле А-В большую часть времени «проводит» у атома В, чем у атома А, тогда как в неполярной молекуле А-А эта пара одинаково часто бывает у обоих атомов А. Альтернативное утверждение состоит в том, что в полярной молекуле А-В электронная пара, образующая связь между А и В, «смещена» в сторону В, а в неполярной молекуле А-А она «не смещена» ни к одному, ни к другому атому. Такие эффекты рассматриваются в теории электронных смещений. В этой теории выбирают некоторую эталонную «молекулу для сравнения», обычно А-Н (Н - атом водорода), и затем электронное строение молекулы А-В рассматривают в сравнении с эталоном А-Н. Если, например, В - более электроотрицательный элемент, чем Н, в молекуле А-В электронная плотность у атома А должна быть меньше, чем у атома А в молекуле А-Н, а электронная плотность у атома В должна быть больше, чем у атома Н в молекуле А-Н. Схематически это отображают формулами с частичными зарядами и с прямыми (для электронов σ-симметрии) или изогнутыми (для электронов π-симметрии) стрелками, обозначающими смещение электронной плотности, вызванное заменой в молекуле А-Н атома водорода на атом В.

Например, взяв за стандарт молекулу метана, электронные формулы фторметана и формальдегида можно записать следующим образом:
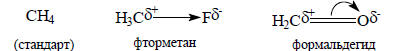
Теория электронных смещений возникла в 1920-х годах, задолго до широкого развития метода молекулярных орбиталей, которое, по существу, началось только в 1950-х годах (хотя первые работы В.Хюккеля по молекулярным орбиталям органических π-систем появились в начале 1930-х годов). Эта теория очень хорошо и просто объясняет большинство экспериментальных фактов, связанных со строением и реакционной способностью органических соединений, поэтому она широко используется до настоящего времени. В последующих главах мы наряду с методом молекулярных орбиталей будем параллельно использовать и представления об электронных эффектах, развитые в теории смещений электронных пар.
Смотрите также
Рефрактометрический метод анализа в химии
Рефрактометрический метод имеет многолетнюю историю
применения в химии.
Рефрактометрия
(от латинского refraktus
– преломлённый и греческого metréō – мерю, измеряю) – это разд ...
Химическая термодинамика
В
результате химической реакции выделяется или поглощается энергия, так как
реакция сопровождается перестройкой энергетических уровней атомов или молекул
веществ, участвующих в ней, и веще ...
Основные
результаты и выводы
1.
При исследовании поведения молекул дизамещенного фуллерена С60 при
формировании плавающих слоев ...


