Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Метод молекулярных орбиталей (ММО)Открытая химия / Химическая связь / Открытая химия / Химическая связь / Метод молекулярных орбиталей (ММО) Метод молекулярных орбиталей (ММО)Страница 1
Метод молекулярных орбиталей исходит из того, что каждую молекулярную орбиталь представляют в виде алгебраической суммы (линейной комбинации) атомных орбиталей. Например, в молекуле водорода в образовании МО могут участвовать только 1s атомные орбитали двух атомов водорода, которые дают две МО, представляющие собой сумму и разность атомных орбиталей 1s1 и 1s2 – МО± = C11s1 ±C21s2.
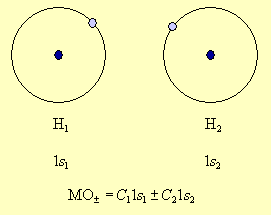 |
|
Рисунок 3.6 |
Поскольку ядра во взаимодействующих атомах водорода одинаковы, то и вклад атомных орбиталей будет одинаковым, что обеспечивается равенством коэффициентов, с которыми s-орбитали участвуют в линейной комбинации (C1 = C2 = C). Поскольку должно выполняться требование, что сумма квадратов коэффициентов при АО равна 1, то имеем 2C2 = 1, откуда ![]() Опуская этот нормировочный множитель, запишем две молекулярные орбитали как сумму и разность АО атомов водорода:
Опуская этот нормировочный множитель, запишем две молекулярные орбитали как сумму и разность АО атомов водорода:
|
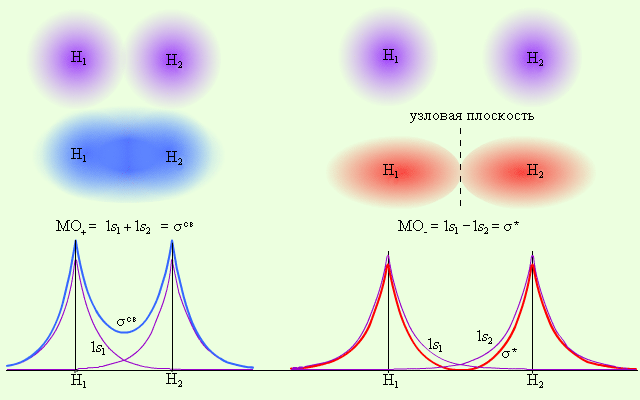
Электронная плотность этих двух состояний пропорциональна |MO±|2. Поскольку в молекуле водорода взаимодействие возможно только по оси молекулы, то каждая из MO± может быть переобозначена как σсв = 1s1 + 1s2 и σ* = 1s1 – 1s2 и названа соответственно связывающей (σсв) и разрыхляющей (σ*) молекулярными орбиталями (рис. 3.7).
 |
|
Рисунок 3.7 Распределение электронной плотности в молекуле H2 |
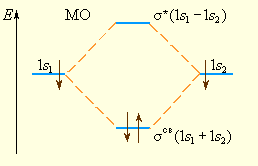
Из рис. 3.7 видно, что электронная плотность посередине между ядрами для σсв значительна, а для σ* равна нулю. Отрицательно заряженное электронное облако, сконцентрированное в межъядерном пространстве, притягивает положительно заряженные ядра и соответствует связывающей молекулярной орбитали σсв. А МО с нулевой плотностью в межъядерном пространстве соответствует разрыхляющей орбитали σ*. Состояния σсв и σ* отвечают разным уровням энергии, причем молекулярная орбиталь σсв имеет более низкую энергию по сравнению с исходными АО двух невзаимодействующих атомов водорода 1s1 и 1s2 (рис. 3.8).
 |
|
Рисунок 3.8 Энергетическая диаграмма атомных и молекулярных уровней водорода |
Переход двух электронов на МО σсв способствует понижению энергии системы; этот энергетический выигрыш равен энергии связи между атомами в молекуле водорода H–H. Даже удаление одного электрона с МО (σсв)2 c образованием (σсв)1 в молекулярном ионе ![]() оставляет эту систему более устойчивой, чем отдельно существующие атом H и ион H+.
оставляет эту систему более устойчивой, чем отдельно существующие атом H и ион H+.
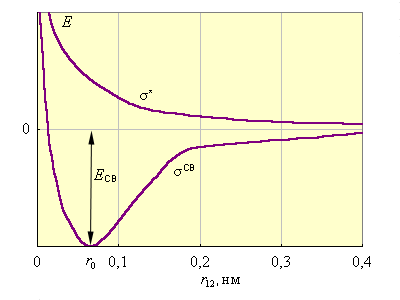
Рис. 3.9 иллюстрирует изменение энергии МО σсв и σ* в зависимости от межатомного расстояния r12. При большом расстоянии r12 их энергия будет мало отличаться от энергий АО 1s1 и 1s2. При некотором ![]() энергия σсв достигнет минимума и будет соответствовать энергии связи Eсв молекулы H–H. При дальнейшем сближении ядер энергии σсв и σ* начинают повышаться, поскольку силы отталкивания начинают преобладать над силами притяжения. В молекуле ядра колеблются вблизи равновесного расстояния
энергия σсв достигнет минимума и будет соответствовать энергии связи Eсв молекулы H–H. При дальнейшем сближении ядер энергии σсв и σ* начинают повышаться, поскольку силы отталкивания начинают преобладать над силами притяжения. В молекуле ядра колеблются вблизи равновесного расстояния соответствующего минимуму энергии
![]() .
.
 |
|
Рисунок 3.9 Энергии МО в H2 в зависимости от межъядерного расстояния. |
Смотрите также
Биокерамика на основе фосфатов кальция
В последние годы значительное
внимание уделяется созданию керамических материалов медицинского назначения, предназначенных
для использования при реконструкции дефектов костных тканей, образу ...
Амины
По
систематической номенклатуре амины называют путем добавления приставки амин к
названию углеводорода. По рациоальной номенклатуре их рассматривают как алкил
или ариламины.
Гетероциклич ...
Изучение и анализ производства медного купороса
Целью
данного дипломного проекта является изучение и анализ производства медного
купороса, основанного на переработке отработанного передаточного электролита
цеха электролиза меди.
В
хо ...


