Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Спаривание атомных орбиталей. Теория валентных связейОрганическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Спаривание атомных орбиталей. Теория валентных связей Спаривание атомных орбиталей. Теория валентных связей
Теория молекулярных орбиталей, как мы видели, является естественным распространением на молекулы тех идей, которые сначала были использованы для объяснения электронного строения атомов. Однако молекулярно-орбитальная теория строения исторически не была первой; она просто очень быстро развилась из-за того, что ее легче приспособить для расчетов на компьютерах, чем другие теории. Исторически первой была теория валентных связей, которая используется и в настоящее время.
В отличие от метода молекулярных орбиталей основная идея метода валентных связей состоит в предположении, что атомные орбитали в молекуле в известной мере сохраняют свою индивидуальность. Волновая функция многоэлектронной молекулы строится путем спаривания орбиталей отдельных атомов, а понятие «молекулярная орбиталь» в теории валентных связей просто не нужно.
В качестве примера рассмотрим простую молекулу ВеН2. В основном состоянии атом Ве имеет электронную конфигурацию 1s22s2 (разд. 1.4.3). В химических соединениях бериллий двухвалентен, поэтому его валентные электроны (на уровне с n=2) нужно распарить на орбитали 2s и 2р.
Следовательно, электронная конфигурация валентного состояния атома Ве будет 1s22s2р. Таким образом, в образовании химических связей в молекуле ВеН2 участвуют четыре валентные АО: {Be2s, Be2p и HA1s и HB1s} (индексы А и В соответствуют разным атомам водорода). Совокупность всех АО, т.е. {Be2s, Be2p, HA1s, HB1s} называется конфигурацией.
Полная волновая функция молекулы включает две части: координатную и спиновую. Согласно теории, координатная волновая функция записывается как произведение АО:
ψкоорд = [Be2s(1)][Be2p(2)][HA1s(3)][HB1s(4)]
где цифрой в круглых скобках отмечен условный порядковый номер каждого электрона.
Затем ψкоорд нужно умножить на спиновую волновую функцию Θспин, что требует очень громоздких алгебраических вычислений. Суть состоит в том что необходимо из N электронов, участвующих в образовании химических связей в молекуле, составить N/2 комбинаций путем спаривания α- и β-спинов. Но разбиение молекулярных электронов на пары, внутри которых спариваются спины, можно осуществить многими способами. В случае ВеН2 вариантов разбиения три:

Каждому варианту разбиения соответствует функция, называемая валентно-связной (ВС), или просто валентной структурой. Число валентных структур (n) , достаточное для описания многоэлектронных молекул по формуле Гайтлера-Румера, составляет
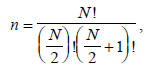
где N - число спаривающихся валентных орбиталей. Для ВеН2 N=4, т.е. n =2, и следовательно, из трех валентных структур нужны только две. Какие же из этих структур выбрать? С математической точки зрения это безразлично, но химик, безусловно, отдаст предпочтение структурам (I) и (II), так как обе схемы спаривания атомных орбиталей графически легко отождествляются с классической структурной формулой Н-Ве-Н. Структуру (III) можно рассматривать как «молекула водорода плюс атом бериллия», но не как соединение ВеН2, поскольку в ней атомы Ве и Н не связаны.
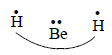
Тогда полная волновая функция молекулы ВеН2 примет вид
ψВС = ψкоорд (CIθI + CIIθII),
где индекс ВС означает, что расчет проводился в рамках метода валентных связей. Атомные орбитали Be2s и HA1s и атомные орбитали Ве2р и HВ1s в структуре (I) называются спаренными. В структуре (II) спарены орбитали Ве2р- HA1s и Be2s-HВ1s, а в структуре (III) - орбитали Be2s-Ве2р и HA1s-HВ1s.
Смотрите также
Неорганические соли в пиротехнической промышленности
Пиротехника в современной индустрии и науке занимает особое место среди
остальных отраслей. Ей принадлежат ужасающие (на службе военной промышленности или
терактов) и захватывающие (в роли м ...
Автоматизация процесса прокалки кокса
Прокаленный кокс используется для изготовления
электродов, применяемых в электролизерах для электролиза алюминия. Кокс
прокаливается с целью удаления влаги и летучих компонентов для улучшени ...


