Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Гибридизация и форма многоатомных молекул. ГибридизацияОрганическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Гибридизация и форма многоатомных молекул. Гибридизация Гибридизация и форма многоатомных молекул. ГибридизацияСтраница 1
В случае гомоядерных молекул мы проводили комбинацию АО, пользуясь правилом, согласно которому наиболее сильно взаимодействуют орбитали одинаковой энергии. В гетероядерных молекулах типа АВ энергетические уровни атомов А и В неодинаковы, поэтому трудно однозначно утверждать, какие орбитали будут комбинироаться. Для случая LiH это показано на рис. 1.11.
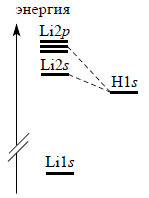
Рис. 1.11. Энергетические уровни АО Li и Н.
Хотя уровень Li2s лежит ближе к H1s, но не так далек и уровень Li2p. Поэтому вряд ли справедливо рассматривать только связь H1s-Li2s. Лучше получается, если взять линейную комбинацию всех трех орбиталей:
ψ=С1(Li2s)+С2(Li2p)+С3(H1s)
Смысл этого уравнения графически можно выразить следующим образом. Молекула Li-H полярная, так как атомы Li и Н отличаются по электроотрицательности. Следовательно, плотность связывающей σ-орбитали связи Li-Н будет больше на атоме водорода. Другими словами, связывающая σ-орбиталь по энергии и по форме более похожа на 1s-орбиталь водорода, а 2s- и 2р-орбитали лития имеют относительно небольшие коэффициенты в линейной комбинации, что указывается помещением этих орбиталей в скобки:
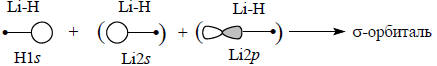
Чтобы построить σ-орбиталь, можно сначала сгруппировать две орбитали лития в две гибридные орбитали Lih1 и Lih2, имеющие форму несимметричной гантели, из-за того что при наложении сферическим симметрической s-орбитали на гантелеобразную р-орбиталь с одной стороны узловой плоскости р-орбитали волновые функции интерферируют положительно, а с другой стороны - отрицательно.
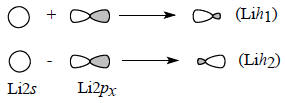
Далее можно считать, что одна связь образуется в результате перекрывания H1s с одной из гибридных орбиталей, т.е.
ψ=C1(Li, гибридная) + С2(H1s).
Очевидно, что связывание будет осуществляться орбиталью Lih2, бóльшая доля которой направлена в сторону атома Н:
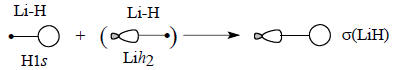
Аналогично, антисвязывающая σ*-орбиталь связи Li-Н может быть построена из гибридной орбитали лития и 1s-орбитали водорода. Для этого используется орбиталь Lih1, меньшая доля которой направлена в сторону атома Н. Это выгоднее, чем ситуация, когда в сторону атома водорода направлена бóльшая доля гибридной орбитали, так как в первом случае перекрывание будет меньше и «антисвязь» будет слабее.
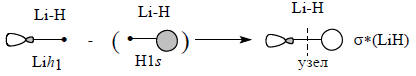
Отметим, что в орбиталь σ* главный вклад вносят орбитали лития, что отражена на схеме относительными размерами АО.
Представлениями о гибридных АО в органической химии пользуются очень широко, поскольку при этом сохраняется главная и самая привлекательная особенность теории МО: связь между двумя атомами образуется взаимодействием только двух, а не трех АО. Так за счет усложнения удается сохранить простоту теории МО. Введение понятия гибридизации не обусловлено ни математической, ни физической необходимостью, а продиктовано лишь желанием найти наиболее простое описание связи.
Смотрите также
Новые научные направления современной химии и их прикладное использование
Химия
- наука социальная. Её высшая цель – удовлетворять нужды каждого человека и
всего общества. Многие надежды человечества обращены к химии. Молекулярная
биология, генная инженерия и би ...
Углеводы как главный источник энергии в организме человека
...
Оксираны (эпоксиды)
Оксиранами (старое
название эпоксиды) называют трехчленные циклические соединения, содержащие один
атом кислорода в цикле.
...


