Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Гетероядерные двухатомные молекулыОрганическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Гетероядерные двухатомные молекулы Гетероядерные двухатомные молекулыСтраница 1
Если молекула АВ состоит из двух разных атомов, то, во-первых, распределение электронной плотности в ней становится несимметричным, а, во-вторых, атомные энергетические уровни слева и справа на рис. 1.10 становятся неодинаковыми.
Степень асимметричности связи зависит от природы образующих молекулу атомов. Можно выделить два крайних случая: чисто ковалентную связь и чисто ионную связь. Первая характеризуется совершенно симметричным распределением электронов, как в гомоядерных двухатомных молекулах, а вторая - полным переносом заряда от одного атома к другому. Тогда формулу молекулы лучше записать в виде А+В-, а связь между атомами описывать как кулоновское взаимодействие между двумя ионами. Промежуточный между этими крайними случаями асимметричности связи отвечает так называемая полярная связь, для которой характерно неполное смещение электрона от одного атома к другому; в результате у одного из атомов возникает частичный положительный заряд, а у другого - частичный отрицательный заряд. Примером является молекула HF, которую можно описать как Hδ+Fδ-.
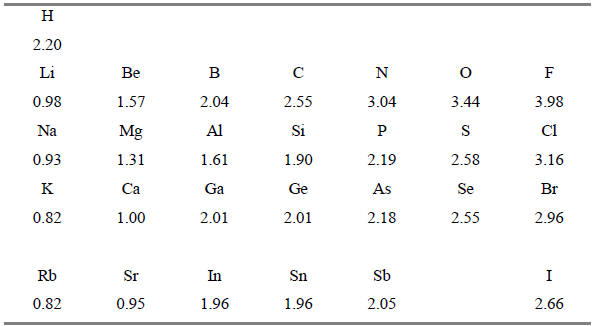
Степень полярности связи рассчитывают или из экспериментальных данных, например из дипольных моментов, или из детальных молекулярно-орбитальных расчетов. Однако приблизительно полярность связей можно оценить из таблицы электроотрицательности элементов, в которой способность атома притягивать электроны обозначают числом. Существует несколько таблиц электроотрицательности, но самой известной является таблица Полинга (табл. 1.1).
В квантовой механике каждая МО строится из атомных орбиталей путем их линейной комбинации. В общем, любая связывающая МО записывается выражением
ψ=САϕА+СВϕВ,
где ϕА и ϕВ - атомные орбитали, при взаимодействии которых образуется данная молекулярная орбиталь, а СА и СВ - коэффициенты, с которыми они входят в МО. Доля ϕА в рассматриваемой МО равна квадрату коэффициента СА, т.е. СА2, а доля ϕВ равна СВ2. По условию нормировки (см. разд. 1.3.) сумма квадратов коэффициентов должна быть равна единице. Для чисто ковалентной связи СА2=СВ2=1/2, поскольку СА2+СВ2=1, а для чисто ионной связи А+В- СА2=0 и СВ2=1. Для полярной молекулы Аδ+Вδ- СА2<1/2, тогда как СВ2>1/2.
Рассмотрим полярную молекулу HF. Связь между атомами Н и F в этой молекуле образуется перекрыванием орбиталей Н2s и F2s, однако коэффициенты, с которыми эти орбитали входят в линейную комбинацию, в результате которой образуется связывающая σ-МО, не одинаковы, а именно CF>CH. Схематически это можно изобразить, используя «кружки» или «восьмерки» (в случае р-орбиталей) разных размеров; радиусы можно взять пропорциональными CF и CH в молекуле Hδ+Fδ-, тогда площади будут пропорциональны CF2 и CH2.
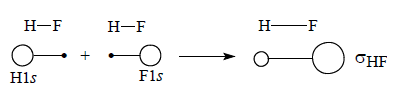
Приведенная упрощенная схема показывает, что плотность связывающей σ-орбитали в молекуле HF больше на атоме F, чем не атоме Н.
В действительности картина связывания атомов в молекуле HF несколько сложнее, поскольку возможно не только перекрывание s-орбиталей, но и перекрывание между орбиталями H1s и F2p:
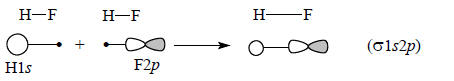
Такое перекрывание увеличивает плотность орбитали между атомами Н и F, что ведет к понижению энергии молекулы. Однако в основном связь между H и F обеспечивается перекрыванием s-орбиталей (ср. рис. 1.17).
Смотрите также
Индол. Порфин. Тетраазапорфин. Фталоцианины
Введение
Гетероциклическими
называют соединения, содержащие циклы, включающие один или несколько
гетероатомов. Наиболее устойчивыми являются пяти- и шестичленные циклы.
Гетероцикли ...
Неметаллы
Все многообразие окружающей нас природы
состоит из сочетаний сравнительно небольшого числа химических элементов.
В различные
исторические эпохи в понятие «элемент» вкладывался различный с ...


