Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Гомоядерные двухатомные молекулыОрганическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Гомоядерные двухатомные молекулы Гомоядерные двухатомные молекулыСтраница 2
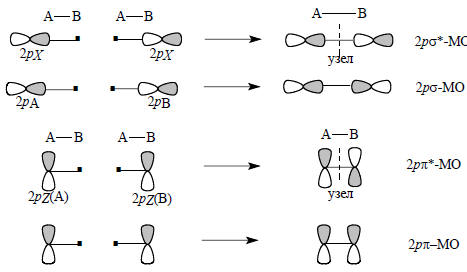
Схематически образование положение 2рσ- и 2рπ-орбиталей можно изобразить следующим образом:
s,p-Перекрывание. Перекрывание двух s-орбиталей или двух р-орбиталей приводит к образованию прочных ковалентных связей, но при sp-перекрывании образуются менее прочные связи. Главная причина этого связана со следующим правилом: прочные ковалентные связи образуются при взаимодействии АО примерно одинаковой энергии.
Как мы увидим ниже, это правило применимо и к взаимодействию между молекулами, т.е. не только к АО, но и МО.
В гомоядерных молекулах N2, O2, F2 энергии 2s-АО одинаковы, одинаковы и энергии 2р-АО. В гетероядерных молекулах, например, в СН4, NH3, Н2О , в принципе возможно образование связей путем sp-перекрывания, как показано на рис. 1.9,а; при этом образуются связи σ-типа. Однако из-за того, что s- и р-орбитали значительно отличаются по энергии, такие σ-связи должны быть слабыми.
Важно понять, что связывание не произойдет, если пытаться перекрыть орбитали так, как показано на рис. 1.9,б. Здесь две орбитали «перекрываются» лишь в формальном смысле слова, на самом же деле в одной области (сверху на рисунке) их амплитуда увеличена, а в другой области (снизу) точно в такой же степени уменьшена. Таким образом, связывание сверху уничтожается антисвязыванием снизу, т.е. суммарного взаимодействия нет.
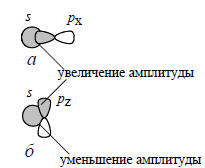
Рис. 1.9. sp-перекрывание
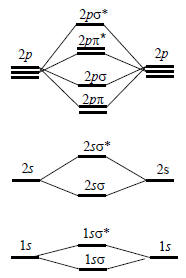
Рис.10.1. Энергии МО для гомоядерных двухатомных молекул элементов второго периода
Возможность или невозможность взаимодействия между двумя орбиталями связана с симметрией этих орбиталей относительно одного и того же элемента симметрии. Взаимодействовать могут орбитали только одинаковой симметрии. На рис. 1.9,а обе орбитали, s- и р-, симметричны относительного горизонтальной плоскости, проходящей через межъядерную линию, а на рис. 1.9,б s-орбиталь симметрична, а pz-орбиталь антисимметрична. Поэтому в первом случае есть взаимодействие, а во втором случае его нет.
Электронная конфигурация двухатомных молекул. На рис. 1.10 слева и справа показаны энергетические уровни атомов, а в центре - энергетические уровни молекул. Это чисто качественная диаграмма, на самом деле энергетические уровни имеют совершенно определенные значения для разных молекул и, если нужно их точно знать, они рассчитываются методом самосогласованного поля. Однако для выяснения электронной конфигурации молекул достаточно и этой качественной диаграммы. В качестве иллюстрации рассмотрим молекулы азота и кислорода.
Азот. Молекула N2 имеет 14 электронов. В основном состоянии два электрона со спаренными спинами размещаются на нижней 1sσ-орбитали. Еще два электрона к ним присоединиться уже не могут, и занимают поэтому следующую низшую 1sσ*-орбиталь. Следующие 4 электрона занимают попарно 2sσ- и 2sσ*-орбитали. Уровень 2рπ вырожден, он состоит из двух орбиталей, одна из которых образовани 2рх-перекрыванием, а другая - 2py-перекрыванием, следовательно, здесь можно поместить 4 электрона. Итак, мы уже разместили 12 электрнов, оставшиеся два займут 2рσ-орбиталь. Таким образом, конфигурацию молекулы N2 можно записать как 1sσ21sσ*22sσ22sσ*22рπ42рσ2.
Глядя на эту запись, мы уверенно можем указать, сколько связей удерживают атомы вместе. Орбиталь 1sσ заполнена и является связывающей. Но заполнена также и разрыхляющая орбиталь 1sσ*, и она аннулирует связывающий эффект орбитали . Аналогично компенсируются и 2sσ-«связь» и 2sσ*-«антисвязь». Но заполненная 2рσ-орбиталь не аннулируется, так как соответствующая 2рσ*-пустая; то же справедливо и для двух 2рπ-связей. Следовательно, общее число связей равно трем, что хорошо согласуется со старой формулой азота N≡N.
Кислород. Молекула О2 имеет 16 электронов, т.е. на два электрона больше, чем молекула N2. Эти два электрона могут занимать разрыхляющую 2рπ*-орбиталь. О2 тогда будет иметь конфигурацию 1sσ21sσ*22sσ22sσ*22рπ42рσ22рπ*2. Следовательно, число связей в молекуле О2 равно двум, что согласуется с классической формулой О=О. Из вида этой классической формулы мы могли бы заключить, что двойная связь в О=О, как обычно, состоит из одной двухэлектронной σ-связи и одной двухэлектронной π-связи. Однако это не так.
Смотрите также
О спонтанном деформировании ацетатных волокон в парах нитрометана
Целлюлоза – один из
наиболее распространенных природных полимеров, широко используемых в различных
областях народного хозяйства. Также широко применяются производные целлюлозы,
особенно аце ...
Анализ почв и агрохимический анализ
...
Современные тенденции и новые направления в науке о полимерах
Современные
тенденции и новые направления в науке о полимерах ярко проиллюстрированы в
рамках исследований проведенных Российским Фондом Фундаментальных Исследований
(РФФИ)
В настоящее в ...


