Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Связывающие и разрыхляющие орбиталиОрганическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Связывающие и разрыхляющие орбитали Связывающие и разрыхляющие орбиталиСтраница 1
При образовании молекулярной (1sA+1sB)-орбитали две атомные орбитали находятся в положительной (конструктивной) интерференции, т.е. взаимодействие их происходит в фазе. Занимающий эту орбиталь электрон связывает два ядра в единую систему, но в тесный контакт друг с другом ядра войти не могут. Это обусловлено двумя причинами. Во-первых, при очень малых межъядерных расстояниях электрону просто не хватает места, чтобы находиться между ядрами, и его связывающий эффект уменьшается. Во-вторых, при уменьшении расстояния возрастает отталкивание ядер, которое в конце концов должно превысить связывающее действие электрона. Для любого расстояния между ядрами можно вычислить общую энергию молекулы; полученная зависимость носит название кривой потенциальной энергии молекулы (рис. 1.4). На кривой имеется минимум («яма»), соответствующий стабильному состоянию молекулы с межъядерным расстоянием Rравн, которое носит название равновесной длины связи (или просто длины связи; в ионе Н2+. Rравн=1.06 Å). (1sA+1sB)-Орбиталь является связывающей молекулярной орбиталью в соответствии с определением: молекулярная орбиталь называется связывающей, если заселение ее электронами приводит к понижению общей энергии молекулы.
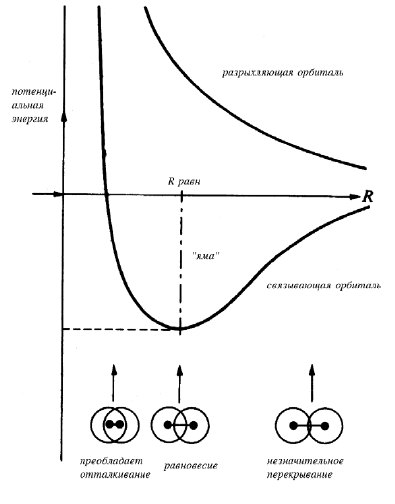
Рис. 1.4. Кривые потенциальной энергии иона Н2+.
Другую МО иона Н2+., которая является следующим точным решением уравнения Шредингера, можно смоделировать, комбинируя орбитали 1sA и 1sB в противофазе (рис. 1.5). Эта комбинация записывается как 1sA-1sB, что совершенно эквивалентно записи 1sВ-1sА, так как выбор знака волновых функций произволен. В этом случае в области перекрывания наблюдается отрицательная (деструктивная) интерференция двух АО, вследствие чего электрон, занимающий 1sA-1sB-орбиталь, не занимает места между ядрами. Вероятность распределения электрона дается выражением
(1sA-1sB)2dτ =(1sA)2dτ +(1sB)2dτ - 2(1sA)(1sB)dτ.
Принципиальное отличие между этой орбиталью и орбиталью связывающей состоит в том, что третий член в приведенной формуле отрицателен, т.е. электронная плотность в межъядерной области уменьшается (рис. 1.5). В плоскости, проходящей через середину связи, где орбитали 1sA и 1sB имеют равные амплитуды, отрицательная интерференция максимально полная, и поэтому в орбитали возникает узел. Электрон, занимающий (1sA-1sB)-орбиталь, стремится «растолкнуть» ядра. Частично это обусловлено тем, что его почти нет в межъядерной области, и он находится в основном снаружи атомов, а поэтому стремится растянуть связь, чтобы находиться и с внутренней стороны атомов. Вследствие этого (1sA-1sB)-орбиталь является антисвязывающей (другое название - разрыхляющая).
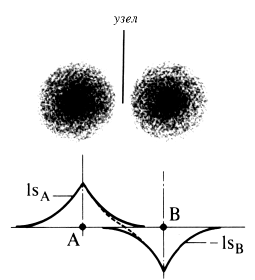
Рис. 1.5. Образование антисвязывающей (разрыхляющей) молекулярной орбитали
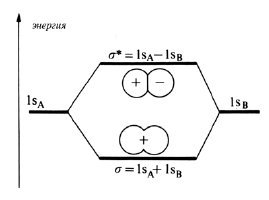
Рис. 1.6. Диаграмма энергетических уровней МО, образованных из 1s-орбиталей
Молекулярная орбиталь называется антисвязывающей (разрыхляющей), если заселение ее электронами приводит к повышению общей энергии молекулы. Зависимость энергии этой орбитали от межъядерного расстояния приведена на рис. 1.4.
На рис. 1.6 показаны энергии связывающей и разрыхляющей орбиталей при расстоянии между ядрами Rравн. Это типичная диаграмма энергетических уровней молекулярных орбиталей. Символом σ обозначают орбитали цилиндрической симметрии относительно межъдерной оси (по аналогии с s-АО); звездочкой (σ*) обозначают разрыхляющие σ-орбитали.
Смотрите также
Приготовление сорбентов и колонок для высокоэффективной жидкостной хроматографии
...
Занимательные опыты по химии
...
Разработка дополнительных занятий в школе к теме "Химизм различных способов приготовления пищи"
Проблема пищи всегда
была одной из самых важных проблем, стоящих перед человеческим обществом.
Все, кроме кислорода,
человек получает для своей жизнедеятельности из пищи. Среднее потребле ...


