Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Масса (объем, количество вещества) продукта по реагенту в
избытке или с примесямиCправочник по химии для подготовки к ЕГЭ / Решение расчетных задач / Cправочник по химии для подготовки к ЕГЭ / Решение расчетных задач / Масса (объем, количество вещества) продукта по реагенту в
избытке или с примесями Масса (объем, количество вещества) продукта по реагенту в
избытке или с примесямиСтраница 1
Избыток и недостаток реагентов.
Количества, массы и объемы (для газов) реагентов не всегда берутся стехиометрическими, т. е. в соответствии с уравнениями реакции. Чаще один из реагентов берется в избытке, а следовательно, другой реагент оказывается в недостатке. Избыток реагента участвовать в реакции не будет.
Для реакции aA + bB = cC + dD
определение реагентов, взятых в избыткеи в недостатке, проводят по неравенству (А – в недостатке, В – в избытке):
![]()
где n(общ. В) – общее (взятое с избытком) количество реагента В, пB – стехиометрическое (необходимое для реакции) количество В, n(изб. В) – избыточное количество В, причем
n(изб. B) = n(общ. B) – nB.
Внимание!
Расчет получаемых количеств (масс, объемов) продуктов проводят по реагенту в недостатке
.
Степень чистоты вещества.
Химические вещества никогда не бывают идеально чистыми, они всегда содержат в себе примеси.
Массовая доля вещества В в смеси, например А + В + С, – это отношение массы вещества В к массе смеси:
![]()
Сумма массовых долей всех веществ смеси равна 1 (100 %).
Если в смеси примесь присутствует в следовом (неопределяемом) количестве, то говорят о практически чистом веществе. Когда же в веществе имеется примесь в заметном (определяемом) количестве, то само вещество называют основным (его количество преобладает), а другое вещество – это и есть примесь.
Степень чистоты основного вещества В – это массовая доля этого вещества в навеске с определенной массой:
![]()
Природные вещества (минералы, руды) всегда содержат заметное количество примеси (примесей).
Пример решения задачи
Углекислый газ поглощается 10 %‑ным раствором аммиака (плотность раствора 957 г/л) с образованием кислой соли. Предварительно СO2 получают термическим разложением 5 кг известняка СаСO3 (степень чистоты 60 %). Установите взятый объем (в литрах) раствора аммиака. Элементы ответа.
1) Составлены уравнения реакций:
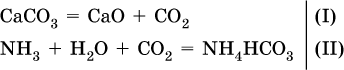
2) Установлено количество основного вещества в известняке:
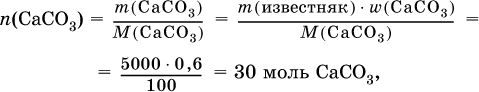
и количество углекислого газа по уравнению (I):
![]()
3) Установлена масса затраченного аммиака по уравнению (II):
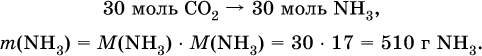
4) Установлен объем взятого раствора аммиака:
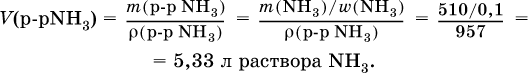
Задания для самостоятельного решения частей В, С
1. К 100 г 10 %‑ного раствора хлорида кальция добавили 100 г 10 % – ного раствора AgNO3. Найдите массу (в граммах) осадка.
2. Смешали горячие растворы, содержащие по 33 г хлорида алюминия и сульфида калия. Установите объем (в литрах, н.у.) выделившегося газа.
Смотрите также
Моделирование парожидкостного равновесия
Выбор модели, адекватно описывающей
фазовое равновесие системы, является важным и необходимым шагом при решении
массообменного процесса. На сегодняшний день разработано достаточно большое
число мет ...
Физико-химические закономерности получения полиамидов (полиамид-6, полиамид-6,6, полиамид-10)
Полиамиды представляют огромный по числу
представителей и очень важный по своему научному и практическому значению класс
высокомолекулярных соединений.
Почти полтора века, которые прошли ...
Термический анализ
Метод исследования
физико-химических и химических превращений, происходящих в минералах и горных
породах в условиях заданного изменения температуры. Термический анализ
позволяет идентифицировать от ...


