Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Электролитическая диссоциацияCправочник по химии для подготовки к ЕГЭ / Водные растворы. Растворимость и диссоциация веществ. Ионный
обмен. Гидролиз солей / Cправочник по химии для подготовки к ЕГЭ / Водные растворы. Растворимость и диссоциация веществ. Ионный
обмен. Гидролиз солей / Электролитическая диссоциация Электролитическая диссоциацияСтраница 1
Растворение любого вещества в воде сопровождается образованием гидратов. Если при этом в растворе не происходит формульных изменений у частиц растворенного вещества, то такие вещества относят к неэлектролитам. Ими являются, например, газ азот N2, жидкость хлороформ СНCl3, твердое вещество сахароза C12Н22О11, которые в водном растворе существуют в виде гидратов их молекул.
Известно много веществ (в общем виде МА), которые после растворения в воде и образования гидратов молекул MA nН2O претерпевают существенные формульные изменения. В результате в растворе появляются гидратированные ионы – катионы М+ • nН2O и анионы А • nН2O:
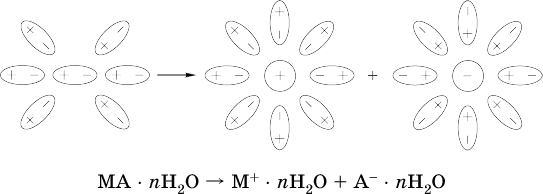
Такие вещества относят к электролитам.
Процесс появления гидратированных ионов в водном растворе
называется электролитической диссоциацией (С. Аррениус, 1887).
Электролитическая диссоциация ионныхкристаллических веществ (М+)(А‑) в воде является необратимойреакцией:
![]()
Такие вещества относятся к сильным электролитам, ими являются многие основания и соли, например:

Электролитическая диссоциация веществ MA, состоящих из полярных
ковалентных молекул, является обратимойреакцией:
![]()
Такие вещества относят к слабым электролитам, ими являются многие кислоты и некоторые основания, например:
а)
![]()
б)
![]()
в)
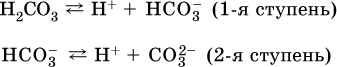
г)
![]()
В разбавленных водных растворах слабых электролитов мы всегда обнаружим как исходные молекулы, так и продукты их диссоциации – гидратированные ионы.
Количественная характеристика диссоциации электролитов называется степенью диссоциации и обозначается α[1], всегда α > 0.
Для сильных электролитов α = 1 по определению (диссоциация таких электролитов полная).
Для слабых электролитов степень диссоциации – отношение молярной концентрации продиссоциировавшего вещества (сд) к общей концентрации вещества в растворе (с):
![]()
Степень диссоциации – это доля от единицы или от 100 %. Для слабых электролитов α « С 1 (100 %).
Для слабых кислот НnА степень диссоциации по каждой следующей ступени резко уменьшается по сравнению с предыдущей:
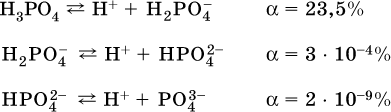
Степень диссоциации зависит от природы и концентрации электролита, а также от температуры раствора; она растет при уменьшенииконцентрации вещества в растворе (т. е. при разбавлении раствора) и при нагревании
.
В разбавленных растворах сильных кислот НnА их гидроанионы Нn‑1А не существуют, например:
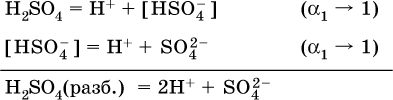
B концентрированных
растворах содержание гидроанионов (и даже исходных молекул) становится заметным:
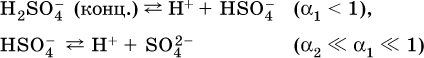
(суммировать уравнения стадий обратимой диссоциации нельзя!). При нагревании значения α1 и α2 возрастают, что способствует протеканию реакций с участием концентрированных кислот.
Кислоты – это электролиты, которые при диссоциации поставляют в водный раствор катионы водорода и никаких других положительных ионов не образуют:
![]()
Распространенные сильные кислоты:

В разбавленном водном растворе (условно до 10 %‑ного или 0,1‑молярного) эти кислоты диссоциируют полностью. Для сильных кислот НnА в список вошли их гидроанионы
(анионы кислых солей), также диссоциирующие полностью в этих условиях.
Распространенные слабые кислоты:
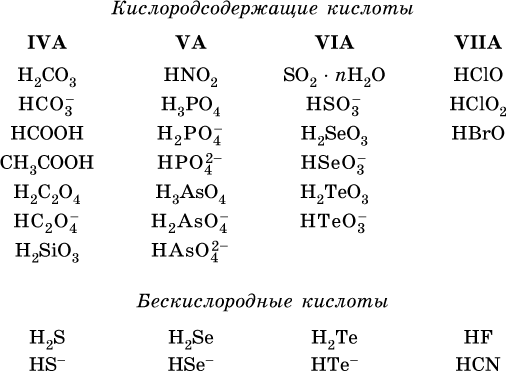
Основания – это электролиты, которые при диссоциации поставляют в водный раствор гидроксид‑ионы и никаких других отрицательных ионов не образуют:
![]()
Диссоциация малорастворимых
Смотрите также
Монокристаллический кремень
Основной объем
монокристаллического кремния (80-90%) потребляемого электронной
промышленностью, выращивается по методу Чохральского.
Фактически весь кремний,
используемый для производст ...
Разработка энергосберегающих технологий процесса ректификации продуктов синтеза хлорбензола
...
Фармацевтический анализ производных фенотиазина
Фенотиазины
- исторически первый класс антипсихотических средств - по своей химической структуре
представляют собой трициклические молекулы.
Все
фенотиазины подразделяются на три основн ...


