Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Обратимость реакцийCправочник по химии для подготовки к ЕГЭ / Химические реакции. Скорость, энергетика и обратимость / Cправочник по химии для подготовки к ЕГЭ / Химические реакции. Скорость, энергетика и обратимость / Обратимость реакций Обратимость реакцийСтраница 1
Химическая реакция называется обратимой, если в данных условиях протекает не только прямая реакция (→), но также и обратная реакция т. е. из исходных веществ образуются продукты и одновременно из продуктов получаются реагенты:
![]()
Обратимые реакции не доходят до конца. Концентрации реагентов уменьшаются, что приводит к уменьшению скорости прямой реакции
. Скорость же обратной реакции
постоянно возрастает, поскольку увеличиваются концентрации продуктов.
Когда скорости прямой и обратной реакций станут одинаковыми (
= ![]()
), наступит состояние химического равновесия, при котором не происходит дальнейшего изменения концентраций реагентов и продуктов.
В состоянии равновесия концентрации реагентов и продуктов постоянны, их называют равновесными концентрациями и обозначают [А], [В], [D] и [Е], в отличие от концентраций сА, св, cD и сЕ в любой другой момент времени. Установлено, что:
В состоянии равновесия произведение концентраций продуктов в степенях, равных стехиометрическим коэффициентам, деленное на такое же произведение концентраций реагентов, есть величина постоянная при T = const.
Такое соотношение обозначают Кс и называют константой равновесия данной реакции:
![]()
Это выражение носит название равновесный закон действующих масс (К. Гулльберг, П. Воге, 1867).
Значение Кс характеризует состояние равновесия в данной реакции и определяется соотношением концентраций, т. е. величина Кс не зависит от каждой в отдельности равновесной концентрации – [А], [В], [D] или [Е].
Химическое равновесие не означает, что наступило состояние покоя. Прямая и обратная реакции протекают и в состоянии равновесия, но с одинаковой скоростью. Поэтому оно называется подвижным (динамическим) равновесием.
Подвижное химическое равновесие можно нарушить, оказывая на систему внешнее
воздействие и тем самым изменяя условия протекания реакции – температуру, давление, концентрацию. При любом нарушении (сдвиге) химического равновесия система перейдет (сместится
) в другое состояние равновесия.
Влияние условий на смещение химического равновесия определяется принципом, который установлен французским ученым A.‑Л. Ле‑Шателье (1884).
Современная формулировка принципа смещения равновесия, называемого принципом Ле‑Шателье:
При воздействии на равновесную систему химическое равновесие смещается в сторону, противодействующую этому воздействию.
Рассмотрим подробнее влияние таких факторов, как температура, давление, концентрация, на смещение равновесия.
1. Температура. Повышение
температуры смещает равновесие обратимой реакции в сторону процесса, идущего с поглощением
теплоты (эндотермическое направление), а понижение
температуры – в сторону процесса, идущего с выделением
теплоты (экзотермическое направление).
Для экзотермической реакции:
![]()
Для эндотермической реакции:
![]()
Значение Кс обязательно изменится при повышении и понижении температуры, так как значения констант скорости k прямой (→) и обратной (←) реакций по‑разному зависят от температуры, ведь это реакции между разными реагентами (соответственно А и В или D и Е). Следовательно, константа равновесия – функция температуры:
Kc = ƒ(t)
Примеры:
а) повышение
температуры (нагревание):
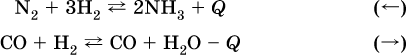
Смотрите также
Образование сложных эфиров. Некоторые производные углеводов
В
живой природе широко распространены вещества, многим из которых соответствует
формула Сх(Н2О)у. Они представляют собой,
таким образом, как бы гидраты углерода, что и обусловило их названи ...
Химия в сельском хозяйстве
Химизация — это одно из направлений научно-технического
прогресса, основанное на широком применении химических веществ, процессов и
методов в различных отраслях, например в сельском хозяй ...
Характеристика абсорбционных методов очистки отходящих газов от примесей кислого характера
Грандиозные
масштабы производственной деятельности человека привели к большим позитивным
преобразованиям в мире – созданию мощного промышленного и сельскохозяйственного
потенциала, широкому ...


