Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Вывод уравнений Ван-дер-Ваальса для жидкой и паровой фаз.Статьи и работы по химии / Исследование фазовых эффектов в бинарных азеотропных смесях / Частные фазовые эффекты и вывод уравнения Ван-дер-Ваальса. / Статьи и работы по химии / Исследование фазовых эффектов в бинарных азеотропных смесях / Частные фазовые эффекты и вывод уравнения Ван-дер-Ваальса. / Вывод уравнений Ван-дер-Ваальса для жидкой и паровой фаз. Вывод уравнений Ван-дер-Ваальса для жидкой и паровой фаз.
Уравнение Ван-дер-Ваальса является представлением разности нулевых потенциалов Гиббса в координатах g-потенциала [14].
Напомним, что для жидкой фазы нулевой потенциал для бинарной смеси обычно записывается в форме [14]
Sж dT –Vж dР+ x1 dμ1 + x2 dμ2=0 2.7
g-потенциал, соответственно, равен
dgж= -Sж dT +Vж dР+ μ1dх1+ μ2 dх2 2.8
Аналогично для паровой фазы имеем
Sп dT –Vп dР+ у1 dμ1 + у2 dμ2=0 2.9
dgп= -Sп dT +Vп dР+ μ1dу1+ μ2 dу2 2.10
В работе [14] дан вывод нулевого потенциала. Приведем его полностью. Для случая бинарной смеси уравнение внутренней энергии имеет вид:
U= TS-PV+ μ1x1+ μ2x2 2.11
После дифференцирования получаем
dU= TdS + SdT – PdV – VdP + μ1 dx1 + x1dμ1 + μ2 dx2 + x2dμ2 2.12
Но так как
dU= TdS - PdV+ μ1 dx1 + μ2 dx2 2.13
то очевидно
SdT-VdP+ x1dμ1+ x2dμ2 =0 2.14 Если применять почленно преобразование Лежандра, то, учитывая, что при этом меняется в каждом случае знак, получим
-SdT+VdP- x1dμ1- x2dμ2 =0 2.15
Автор [14] не видит разницы между уравнениями в форме 2.14 и 2.15, поэтому приводит уравнение 2.15, очевидно считая, что если правая часть равна нулю, то обе формы идентичны.
Как уже говорилось, нулевой потенциал есть скалярное произведение вектора
< S, V, x1, x2 >
на вектор < dT, dP, dμ1, dμ2 >
Учитывая, что это скалярное произведение равно нулю, векторы-сомножители ортогональны друг другу.
Так как, вектор < dT, dP, dμ1, dμ2 > есть вектор параметров, которые могут изменяться независимо, очевидно вектор < S, V, x1, x2 > может быть представлен двояко < S, -V, x1, x2 > или <- S, V, -x1, - x2 >
Оба представления получаются равнозначными, так как эти векторы ортогональны. Проиллюстрируем это при условии Р=соnst. В этом случае имеем
< S, x1, x2 > и <- S, -x1, - x2 > S
S х1 х2 х1
х
-х2 х2
-х
-S -х1 -х2
-х1
- S
Рис.2.10. Взаимное расположение вектора состава
То есть, в случае перемены знаков произведение знака не меняет, если давление постоянно.
Выведем уравнение Ван-дер-Ваальса для жидкой фазы. Исходим из того, что в этом случае начальная точка вектора конноды при Р=соnst будет точка, соответствующая свойствам жидкой фазы. В связи с этим правилом запишем уравнения 2.14 для паровой и жидкой фаз при Р=соnst:
Sп dT + у1 dμ1 + у2 dμ2=0 2.16
Sж dT + x1 dμ1 + x2 dμ2=0 2.17
Отнимем от первого уравнение второе и получим:
(Sп- Sж) dT + (у1- х1)dμ1 +(у2- x2)dμ2=0 2.18
Таким образом, мы, получим произведение конноды жидкость-пар < Sп- Sж, у1- х1, у2- x2> на вектор параметров < dT, dμ1, dμ2 >, которые в условиях термодинамического равновесия одинаковы, как в жидкой, так и в паровой фазах.
Так как х1+х2=1 и у1+у2=1, то очевидно
у1- х1+ у2- x2=0
т.е. у2- x2= -(у1- х1) 2.19
Следовательно, с учетом 2.19
(Sп- Sж) dT + (у1- х1) (dμ1-dμ2)=0 2.20
В уравнении 2.20 dT и d(μ1-μ2) полные дифференциалы.
Для перехода к координатам функции g необходимо выразить d(μ1-μ2), как функции х1 и Т (Р=соnst)
d(μ1-μ2) =![]()
![]() 2.21
2.21
Подставляя в уравнение 2.20 значение d(μ1-μ2) из 2.21, получим
![]() 2.22
2.22
![]() можно представить в виде
можно представить в виде ![]() . В самом деле,
. В самом деле, ![]() ,
, ![]() . Но
. Но ![]() согласно соотношению Максвелла (смешанные производные не зависят от порядка дифференцирования).
согласно соотношению Максвелла (смешанные производные не зависят от порядка дифференцирования).
В связи с этим 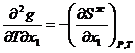 2.23
2.23
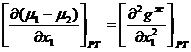 2.24
2.24
Таким образом, с учетом 2.23 и 2.24 окончательно получим
-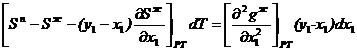 2.25
2.25
Аналогично можно получить для жидкой фазы уравнение при постоянной температуре и переменном давлении
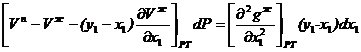 2.26
2.26
Учитывая, что нода для двухкомпонентной смеси определяется разностью концентраций одного из компонентов, уравнения 2.25 и 2.26 можно записать в форме
![]() 2.27
2.27
и
![]() 2.28
2.28
Отметим, что так как в азеотропных смесях коннода вертикальна, нода вырождается в точку.
Смотрите также
Производство фенола
Фенол С6Н5ОН—бесцветное кристаллическое
вещество со специфическим запахом, температурой плавления 43°С, температурой
кипения 181°С, удельным весом 1,071.
Фенол применяется в производстве ...
Глюкоза
...


