Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Альдегиды и кетоныCправочник по химии для подготовки к ЕГЭ / Кислородсодержащие органические соединения / Cправочник по химии для подготовки к ЕГЭ / Кислородсодержащие органические соединения / Альдегиды и кетоны Альдегиды и кетоны
Альдегиды и кетоны– это производные углеводородов, содержащие функциональную карбонильную группу СО
. В альдегидах карбонильная группа связана с атомом водорода и одним радикалом, а в кетонах с двумя радикалами.
Общие формулы:
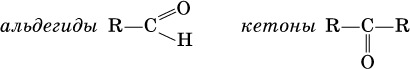
Названия распространенных веществ этих классов приведены в табл. 10.
Метаналь – бесцветный газ с резким удушающим запахом, хорошо растворим в воде (традиционное название 40 %‑ного раствора– формалин), ядовит. Последующие члены гомологического ряда альдегидов – жидкости и твердые вещества.
Простейший кетон – пропанон‑2, более известный под названием ацетон, при комнатной температуре – бесцветная жидкость с фруктовым запахом, tкип = 56,24 °C. Хорошо смешивается с водой.
Химические свойства альдегидов и кетонов обусловлены присутствием в них карбонильной группы СО; они легко вступают в реакции присоединения, окисления и конденсации.

В результате присоединения
водорода к альдегидамобразуются первичные спирты:
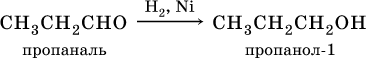
При восстановлении водородом кетоновобразуются вторичные спирты:
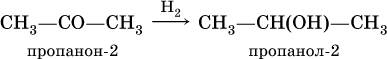
Реакция присоединения
гидросульфита натрия используется для выделения и очистки альдегидов, так как продукт реакции малорастворим в воде:
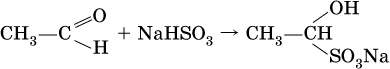
(действием разбавленных кислот такие продукты превращаются в альдегиды).
Окислениеальдегидов проходит легко под действием кислорода воздуха (продукты – соответствующие карбоновые кислоты). Кетоны сравнительно устойчивы к окислению.
Альдегиды способны участвовать в реакциях конденсации
. Так, конденсация формальдегида с фенолом протекает в две стадии. Вначале образуется промежуточный продукт, являющийся фенолом и спиртом одновременно:
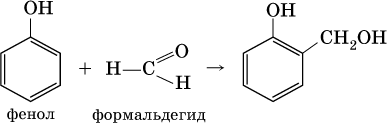
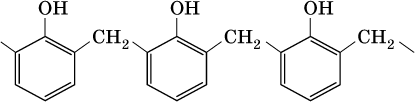
Затем промежуточный продукт реагирует с другой молекулой фенола, и в результате получается продукт поликонденсации
– фенолформальдегидная смола:
Качественная реакция на альдегидную группу – реакция «серебряного зеркала», т. е. окисление группы С(Н)O с помощью оксида серебра (I) в присутствии гидрата аммиака:
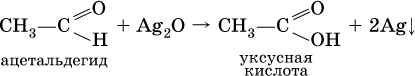
Аналогично протекает реакция с Cu(ОН)2, при нагревании появляется красный осадок оксида меди (I) Cu2O.
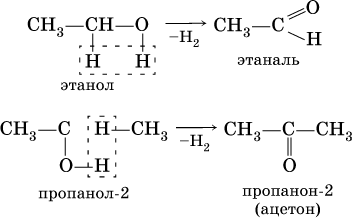
Получение: общий способ для альдегидов и кетонов – дегидрирование (окисление) спиртов. При дегидрировании первичных
спиртов получают альдегиды
, а при дегидрировании вторичных спиртов – кетоны
. Обычно дегидрирование протекает при нагревании (300 °C) над мелкораздробленной медью:
При окислении первичных спиртов сильнымиокислителями (перманганат калия, дихромат калия в кислотной среде) процесс трудно остановить на стадии получения альдегидов; альдегиды легко окисляются до соответствующих кислот:
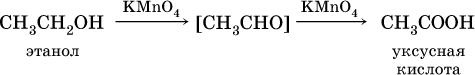
Более подходящим окислителем является оксид меди (II):
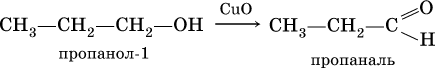
Ацетальдегид в промышленности
получают по реакции Кучерова (см. 19.3).
Наибольшее применение из альдегидов имеют метаналь и этаналь. Метаналь используют для производства пластмасс (фенопластов), взрывчатых веществ, лаков, красок, лекарств. Этаналь – важнейший полупродукт при синтезе уксусной кислоты и бутадиена (производство синтетического каучука). Простейший кетон – ацетон используют в качестве растворителя различных лаков, ацетатов целлюлозы, в производстве кинофотопленки и взрывчатых веществ.
Смотрите также
Азотные,калийные,фосфорные удобрения
...
Физическая химия
...
Атом гелия. Двухэлектронный коллектив на примере атома гелия
1. Обозначение электронной конфигурации – это последовательное перечисление АО с указанием числа электронов справа от символа АО.
2. ...


