Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Алканы. ЦиклоалканыCправочник по химии для подготовки к ЕГЭ / Углеводороды. Гомология и изомерия. Химические свойства и
способы получения / Cправочник по химии для подготовки к ЕГЭ / Углеводороды. Гомология и изомерия. Химические свойства и
способы получения / Алканы. Циклоалканы Алканы. ЦиклоалканыСтраница 1
Алканы
(парафины) – это соединения углерода с водородом, в молекулах которых атомы углерода соединены между собой одинарной связью (предельные углеводороды). Общая формула гомологического ряда алканов СnН2n+2
. Радикал, получающийся при отрыве одного атома водорода от молекулы предельного углеводорода, называется алкилож, общая формула алкилов СnН2n+1
.
Формулы и названия первых шести алканов (С1–С6) и отвечающих им радикалов:
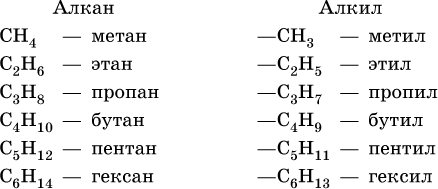
Для радикала С5Н11 использование названия амил не рекомендуется. Для составления названий
алканов с разветвленной цепью, например
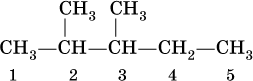
выбирают самую длинную углеродную цепь (в примере – 5 атомов) и получают основу названия (5 – пентан). Нумеруют цепь (от 1 до 5) так, чтобы заместители (–СН3) получили наименьшие номера (2 и 3). В названии арабскими цифрами указывают положение заместителей, а приставками ди
– 2, три
– 3, тетра
– 4 и т. д. – число одинаковых заместителей. Таким образом, в нашем примере алкан должен быть назван 2,3‑диметилпентан.
При наличии разных заместителей их названия расставляют по алфавиту, т. е., например, сначала метил, а затем этил.
Для некоторых разветвленных предельных углеводородов используются, наравне с систематическими, традиционныеназвания, например, для алканов состава С4Н10 и С5Н12 с формулами:
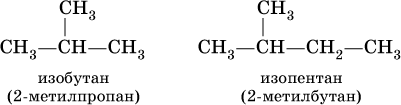
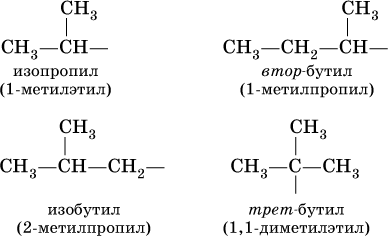
Такие же названия используются для разветвленных радикалов:
При обычных условиях первые алканы – метан, этан, пропан и бутан (С1–С4) – представляют собой газы без цвета и запаха, малорастворимые в воде. Последующие гомологи (С5–C15) – жидкости (при 20 °C), высшие гомологи (C16 и выше) – твердые вещества.
В алканах атомные орбитали углерода имеют sр3‑гибридизацию; четыре электронных облака атома углерода направлены в вершины тетраэдра под углами 109,5°. Ковалентные связи, образуемые каждым атомом углерода, в алканах малополярны.
Поэтому алканы – сравнительно инертные вещества, вступают только в реакции замещения, протекающие с симметричным (радикальным) разрывом связей С – Н. Эти реакции обычно идут в жестких условиях (высокая температура, освещение). В результате становится возможным замещение водорода на галоген (CI, Br) и нитрогруппу (NO2), например, при обработке метана хлором:
![]()
Вторая и последующие стадии реакции протекают легче, чем первая, из‑за смещения электронной плотности к атому хлора:
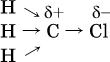
и увеличения подвижности остающихся атомов водорода. Названия продуктов: СН3Cl – хлорметан, СН2Cl2 – дихлорметан, СНCl3 – трихлорметан (хлороформ), СCl4 – тетрахлорметан (тетрахлорид углерода).
В тех алканах, где кроме первичных есть также вторичные и третичные атомы углерода, замещение обычно протекает с образованием смеси однозамещенных продуктов (т. е. в каждой молекуле замещается один атом водорода), например:
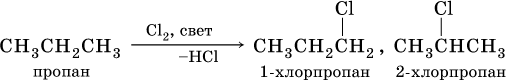
Смотрите также
Химия каренов
Одним из наиболее
распространенных монотерпеновых углеводородов является 3-карен —
3,7,7-триметилбицикло[4.1.0]гепт-3-ен (1), входящий в состав многих
эфирных масел и скипидаров.
мо ...
Полиэфирсульфоны
Полиэфирсульфоны получают
поликонденсацией щелочных солей дифенолов с ароматическими дигалогенидами, в
которых атомы галогена активированы электроноакцепторной группой – SO2 – .
Процесс проводят ...


