Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Исследование процессов кислотной и термической инактивации.Статьи и работы по химии / Исследование некоторых физико-химических свойств протеиназы Penicillium wortmannii / Получение препаратов протеиназы penicillium wortmannii 2091 и
исследование их физико-химических свойств. / Статьи и работы по химии / Исследование некоторых физико-химических свойств протеиназы Penicillium wortmannii / Получение препаратов протеиназы penicillium wortmannii 2091 и
исследование их физико-химических свойств. / Исследование процессов кислотной и термической инактивации. Исследование процессов кислотной и термической инактивации.Страница 1
Изучение термо- и рН-стабильности ферментов часто несёт прикладной характер.
Исследование этих характеристик проводится остаточной активностью фермента после выдержки его раствора в течение некоторого времени при определённых рН и температуре [11].
Нами были проведены исследования кинетики кислотной и термической инактивации протеиназ Penicillium wortmannii 2091 и рассчитаны кинетические параметры этого процесса.
При изучении термо- и рН –стабильности раствор препарата выдерживали в фосфатном буфере в диапазоне рН от 5,0 до 12,0 и температур от 30 до 60оС. Периодически отбирали аликвотные доли раствора и определяли остаточную протеолитическую активность.
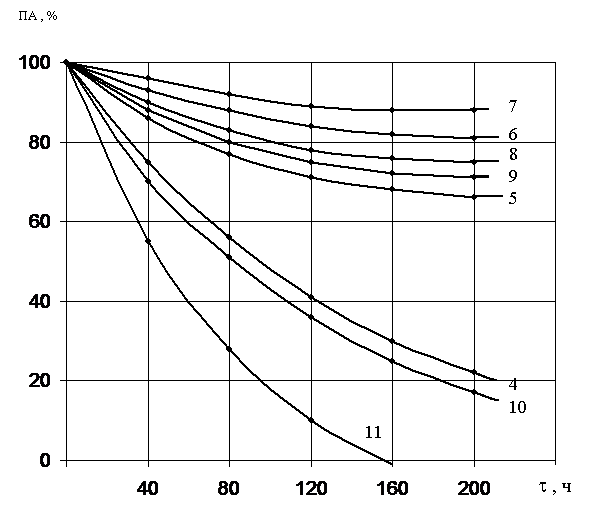
Полученные результаты по инактивации обоих ферментов показали, что протеиназа 1 сохраняет активность в широком диапазоне рН. При значении рН 7,0 через 200 часов фермент сохраняет около 90% активности (рис.4). При значениях рН 6,0 – 9,0 активность фермента снижается до 70 – 75%, это указывает на то, что фермент в указанном интервале не подвержен автолизу, а, следовательно, его нативная конформация обладает высокой стабильностью. При значениях рН ниже 6,0 и выше 11,0 каталитическая активность фермента быстро снижается.
Во всех случаях ПА/КлА-const, это свидетельствует о том, что мы имеем дело с одним ферментом.
Термическую инактивацию протеиназ изучали в интервале температур 30 – 60оС. Протеиназа 1 в области высокой рН-стабильности инактивируется почти полностью при температуре 60оС в течение 60 часов, в то время как протеиназа 2 при этой же температуре инактивируется полностью уже за 3 часа. Данные свидетельствуют о высокой термостабильности протеиназы 1. Инактивация протеиназы 2, происходящая при высокой температуре, по-видимому, определяется процессом разворачивания белковой глобулы.
Протеиназа 1, обладающая коллагенолитическим действием, нас интересует с практической точки зрения, поэтому были рассчитаны некоторые кинетические характеристики для этого фермента.
Если предположить, что в каждом элементарном акте процесса инактивации фермента под действием Н+ - ионов участвует одна его молекула, то кислотную инактивацию можно представить в виде реакции первого порядка. Кинетическое уравнение первого порядка имеет вид:
2,303 lg E0/E=K,
где Е0 – исходная активность фермента
Е – активность в момент времени
К – константа скорости инактивации, характеризующая потерю активности в течение часа, час-1.
 | |||
| |||
Остаточную активность выражали в процентах от исходной и затем использовали в расчётах констант инактивации. Величину находили, как среднее из 5 – 6 определений (табл.2).
Таблица 2.
Кислотная инактивация протеиназы 1 при температуре 500С.
|
t, ч |
Значения рН | |||||||
|
5,0 |
7,0 |
9,0 |
11,0 | |||||
|
Е |
К*103ч-1 |
Е |
К*103ч-1 |
Е |
К*103ч-1 |
Е |
К*103ч-1 | |
|
0 |
100 |
2 |
100 |
2 |
100 |
2 |
100 |
2 |
|
12 |
65,1 |
37,0 |
100 |
2 |
100 |
2 |
63,2 |
38,1 |
|
24 |
45,2 |
33,6 |
92,3 |
2,33 |
92,3 |
2,33 |
42,3 |
36,0 |
|
48 |
16,8 |
37,7 |
88,0 |
2,54 |
87,8 |
2,54 |
18,1 |
36,3 |
|
96 |
7,6 |
36,8 |
81,0 |
2,23 |
81,5 |
2,19 |
7,0 |
37,1 |
|
120 |
6,7 |
35,7 |
66,3 |
2,50 |
68,2 |
2,30 |
6,5 |
37,7 |
|
144 |
6,5 |
33,1 |
62,2 |
2,56 |
60,9 |
2,54 |
6,0 |
34,0 |
Смотрите также
Производство синтетического пантотената кальция (витамина В3)
Пантотеновая кислота (витамин
В3) открыта Р. Вильямсом в 1933 г. Она была им охарактеризована как стимулятор роста дрожжей. Название свое витамин В3 получил от
греческого термина "везде ...
Физико-химические свойства нефти, газа, воды и их смесей
...


