Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Периодичность атомных характеристикОткрытая химия / Электронное строение атомов / Открытая химия / Электронное строение атомов / Периодичность атомных характеристик Периодичность атомных характеристикСтраница 1
Атомный радиус. За радиус свободного атома принимают положение главного максимума плотности внешних электронных оболочек. Это так называемый орбитальный радиус. При изучении строения молекул и кристаллов атомы и ионы можно рассматривать как имеющие некий эффективный радиус, зависящий от типа химической связи. Если рассматривать только относительные величины атомных радиусов, то легко обнаружить периодичность их зависимости от номера элемента.
В периодах орбитальные атомные радиусы по мере увеличения заряда ядра Z в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром.
В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных оболочек.
У s- и p-элементов изменение радиусов как в периодах, так и в подгруппах более ярко, чем у d- и f-элементов, поскольку d- и f-электроны внутренние. Уменьшение радиусов у d- и f-элементов в периодах называется d- и f-сжатием. Следствием f-сжатия является то, что атомные радиусы электронных аналогов d-элементов пятого и шестого периодов практически одинаковы:
| ||||||
|
Таблица 2.3 |
Эти элементы из-за близости их свойств называются элементами-близнецами.
Образование ионов приводит к изменению ионных радиусов по сравнению с атомными. При этом радиусы катионов всегда меньше, а радиусы анионов всегда больше соответствующих атомных радиусов. Ковалентный радиус равняется половине межатомного расстояния в молекулах или кристаллах простых веществ. Ионные радиусы элементов представлены в табл. 2.4.
Энергией ионизации атома I называется количество энергии, необходимое для отрыва электрона от невозбужденного атома или иона.
Энергия ионизации I выражается в кДж∙моль–1 или эВ∙атом–1. Значение I в электронвольтах численно равно потенциалу ионизации, выраженному в вольтах, поскольку E = e-·I.
Э+ – e– = Э+, ΔH = I1 – первый потенциал ионизации; Э – e– = Э2+, ΔH = I2 – второй потенциал ионизации и т.д. I1 < I2 < I3 < I4 .
Энергия ионизации определяет характер и прочность химической связи и восстановительные свойства элементов.
| ||||||||||||||||||||||||||||||||||||||||||||
|
Таблица 2.5 Потенциалы (энергии) ионизации I1 |
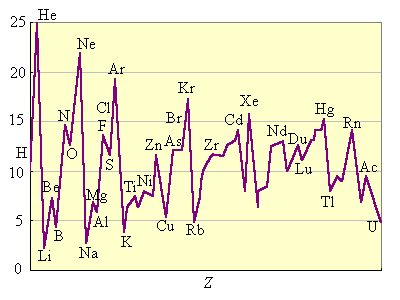
Энергия ионизации изменяется периодически по мере заполнения электронами оболочек атомов (рис. 2.4).
I1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду I1 резко понижается – он минимален у щелочных металлов.
 |
|
Рисунок 2.4 Потенциалы ионизации нейтральных атомов |
Смотрите также
Физико-химические основы адсорбционной очистки воды от органических веществ
Объем потребляемой в мире воды достигает 4 трлн. м3 в год, а
преобразованию со стороны человека подвергается практически вся гидросфера.
Химическая и нефтехимическая отрасли промышленности с ...
Жидкие кристаллы
Некоторое время
тому назад необычной популярностью в США пользовалась новинка ювелирного
производства, получившая название “перстень настроения”. За год было продано 5 0 миллионов таких ...
Основные
результаты и выводы
1.
При исследовании поведения молекул дизамещенного фуллерена С60 при
формировании плавающих слоев ...


