Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
ФосфорCправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Cправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Фосфор ФосфорСтраница 2
Оксокислота. Белое вещество, гигроскопичное, конечный продукт взаимодействия Р2O5 с водой. Молекула имеет строение искаженного тетраэдра [Р(O)(OН)3] (sр3‑гибридизация), содержит ковалентные σ‑связи Р – ОН и σ, π‑связь Р=O. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворяется в воде (548 г/100 г Н2O). Слабая кислота в растворе, нейтрализуется щелочами, не полностью – гидратом аммиака. Реагирует с типичными металлами. Вступает в реакции ионного обмена.
Качественная реакция – выпадение желтого осадка ортофосфата серебра (I). Применяется в производстве минеральных удобрений, для осветления сахарозы, как катализатор в органическом синтезе, компонент антикоррозионных покрытий на чугуне и стали.
Уравнения важнейших реакций:

Получение в промышленности
: кипячение фосфоритной руды в серной кислоте:
Са3(РO4)2 + 3H2SO4 (конц.) = 2Н3РO4
+ 3CaSO4↓
Ортофосфат натрия Na3PO4.
Оксосоль. Белый, гигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Реагируется в растворе с цинком и алюминием. Вступает в реакции ионного обмена.
Качественная реакция на ион РO43‑ – образование желтого осадка ортофосфата серебра (I).
Применяется для устранения «постоянной» жесткости пресной воды, как компонент моющих средств и фотопроявителей, реагент в синтезе каучука. Уравнения важнейших реакций:
Na3PO4 12Н2O = Na3PO4 + 12Н2O (200 °C, вакуум)
2РО43‑ (конц.) + 8Н2O + 2Al = 2[Al(ОН)4]‑ + 2НРО42‑ + ЗН2↑
2РО43‑ (конц.) + 4Н2O + Zn = [Zn(OH)4]2‑ + 2HPO42‑ + Н2↑
2РО43‑ (разб.) + ЗСа2+ = Са3(РO4)2↓
РО43‑ (разб.) + 3Ag+ = Ag3PO4↓ (желт.)↓
Получение: полная нейтрализация Н3РO4 (см.) гидроксидом натрия или по реакции:
2Н3РO4 + 3Na2CO3 = 2Na3PO4
+ 3CO2↑ + 3H2O
Гидроортофосфат натрия Na2HPO4.
Кислая оксосоль. Белый, при умеренном нагревании разлагается без плавления. Хорошо растворим в воде, гидролизуется по аниону. Реагирует с Н3РO4 (конц.), нейтрализуется щелочами. Вступает в реакции ионного обмена.
Качественная реакция на ион НРО42‑ – образование желтого осадка ортофосфата серебра (I).
Применяется как эмульгатор при сгущении коровьего молока, компонент пищевых пастеризаторов и фотоотбеливателей.
Уравнения важнейших реакций:
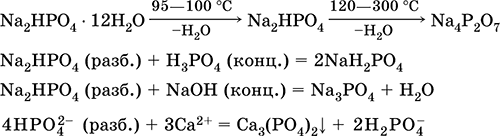
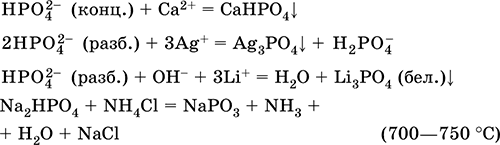
Получение: неполная нейтрализация Н3РO4 гидроксидом натрия в разбавленном растворе:
2NaOH + Н3РO4 = Na2HPO4 + 2Н2O
Дигидроортофосфат натрия NaH2PO4.
Кислая оксосоль. Белый, гигроскопичный. При умеренном нагревании разлагается без плавления. Хорошо растворим в воде, анион Н2РO4 подвергается обратимой диссоциации. Нейтрализуется щелочами. Вступает в реакции ионного обмена.
Качественная реакция на ион Н2РO4 – образование желтого осадка ортофосфата серебра(I).
Применяется в производстве стекла, для защиты стали и чугуна от коррозии, как умягчитель воды.
Уравнения важнейших реакций:
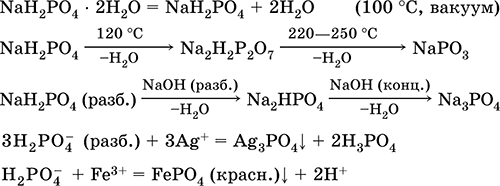
Получение: неполная нейтрализация Н3РO4 едким натром:
Н3РO4 (конц.) + NaOH (разб.) = NaH2PO4
+ Н2O
Ортофосфат кальция
Са3(РO4)2. Оксосоль. Белый, тугоплавкий, термически устойчивый. Нерастворим в воде. Разлагается концентрированными кислотами. Восстанавливается коксом при сплавлении. Основной компонент фосфоритных руд (апатиты и др.).
Применяется для получения фосфора, в производстве фосфорных удобрений (суперфосфаты), керамики и стекла, осажденный порошок – как компонент зубных паст и стабилизатор полимеров.
Уравнения важнейших реакций:
Са3(РO4)2 + 2H2SO4 (60 %) = Са(Н2РO4)2↓ + 2CaSO4↓ (до 50 °C)
Са3(РO4)2 + 4Н3РO4 (40 %) = ЗСа(Н2РO4)2↓ (примесь СаНРO4)
Са3(РO4)2 + 5С + 3SiO2 = 3CaSiO3 + 2Р + 5СО (1000 °C)
Смесь Са(Н2РO4)2 и CaSO4 называется простым суперфосфатом, Са(Н2РO4)2 с примесью СаНРO4 – двойным суперфосфатом, они легко усваиваются растениями при подкормке.
Наиболее ценные удобрения – аммофосы (содержат азот и фосфор), представляют собой смесь аммонийных кислых солей NH4H2PO4 и (NH4)2HPO4.
Смотрите также
Cложные эфиры
...
Свойства калия
...
Расчеты и прогнозирование свойств органических соединений
Задание 24А
на курсовую работу по дисциплине "Расчеты
и прогнозирование свойств органических соединений"
1) Для четырех соединений, приведенных в
таблице, вычислить , , мето ...


