Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Оксиды азота. Азотная кислотаCправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Cправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Оксиды азота. Азотная кислота Оксиды азота. Азотная кислотаСтраница 2
3N2O3 + Н2O = 2HNO3 + 4NO↑
Со щелочами дает соли HNO2, например NaNO2.
Получают взаимодействием NO с O2 (4NO + 3O2 = 2N2O3) или с NO2 (NO + NO2 = N2O3) при сильном охлаждении. «Нитрозные газы» ядовиты и экологически опасны, действуют как катализаторы разрушения озонового слоя атмосферы.
Пентаоксид диазота N2O5.
Бесцветное твердое вещество, O2N – О–NO2, степень окисления азота +V. При комнатной температуре за 10 ч разлагается на NO2 и O2. Реагирует с водой и щелочами как кислотный оксид:
N2O5 + Н2O = 2HNO3
N2O5 + 2NaOH = 2NaNO3 + H2O
Получают дегидратацией дымящей азотной кислоты:
2HNO3 + Р2O5 = N2O5 + 2НРO3
или окислением NO2 озоном при ‑78 °C:
2NO2 + O3 = N2O5 + O2
Азотная
кислота
HNO3.
Оксокислота. Бесцветная жидкость. Молекула имеет искаженно‑треугольное строение [N(O)2(OH)] (sp2– гибридизация), содержит ковалентные σπ‑связи N=O и о‑связь N – ОН. Разлагается при стоянии на свету (желтеет). Хорошо растворяет оксиды азота (красно‑бурая «дымящая» кислота, плотность 1,56 г/мл). Неограниченно смешивается с водой, перегоняется при обычных условиях в виде азеотропной смеси (массовая доля кислоты 68,4 %, плотность 1,41 г/мл, температура кипения 120,7 °C), образует гидрат HNO3 Н2O (точнее, H3NO4 – ортоазотная кислота).
Сильная кислота в растворе, ион NO3‑ имеет строение правильного треугольника (sр2‑гибридизация). Нейтрализуется щелочами и гидратом аммиака. Реагирует с основными и амфотерными оксидами и гидроксидами, вытесняет слабые кислоты из их солей. Сильный окислитель в концентрированном растворе (за счет Nv). Образует смесь продуктов восстановления азота – от NIVO2 до N‑IIIН4+, в зависимости от концентрации кислоты и силы восстановителя в этой смеси преобладают разные продукты (условно для концентрированной кислоты указывают NO2, для разбавленной – NO, для очень разбавленной – NH4+).
Концентрированная кислота пассивирует Al, Be, Bi, Со, Cr, Fe, Ni и Pb, не реагирует с Au и Pt. Смесь HNO3 (конц.) и НCl (конц.) – «царская водка» – обладает еще более сильным окислительным действием: переводит в раствор золото и платину. Нитрующим началом HNO3 в ее реакциях с органическими веществами является ион NO2+ (нитроил).
В отличие от самой кислоты HNO3 ее соли – нитраты проявляют сильные окислительные свойства только при сплавлении за счет выделяющегося кислорода. При нагревании нитраты разлагаются по‑разному, в зависимости от положения металла в ряду напряжений:

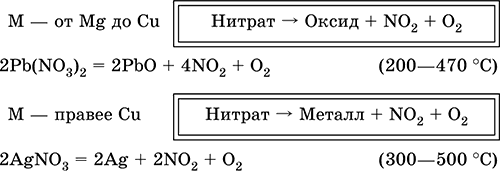
Применяется азотная кислота для производства минеральных удобрений, взрывчатых веществ, нитратов металлов, органических нитропроизводных, искусственных волокон и пластмасс, красителей, лекарственных препаратов.
Уравнения важнейших реакций:
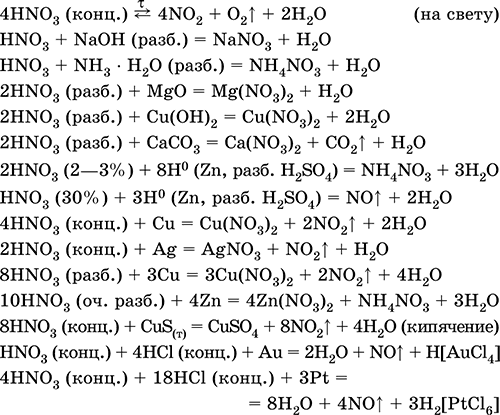
Получение: промышленныйсинтез состоит из следующих этапов:
Смотрите также
Алифатические амины
Амины - производные аммиака, в которых атомы водорода замещены на
углеводородные радикалы. Амины классифицируют по числу атомов водорода,
замещенных на углеводородные радикалы. Различают первичные R ...
Заключение
В
заключение несколько слов о галогенах как об элементах в клетках нашего
организма.
Фтор
постоянно входит в состав животных и растительных тканей; микроэлементов. В
виде неорганических соедин ...
Образование сложных эфиров. Некоторые производные углеводов
В
живой природе широко распространены вещества, многим из которых соответствует
формула Сх(Н2О)у. Они представляют собой,
таким образом, как бы гидраты углерода, что и обусловило их названи ...


