Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Серная кислота. СульфатыCправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Cправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Серная кислота. Сульфаты Серная кислота. СульфатыСтраница 1
Серная кислота
H2SO4.
Оксокислота. Бесцветная жидкость, очень вязкая (маслообразная), весьма гигроскопичная. Молекула имеет искаженно‑тетраэдрическое строение [S(O)2(OH)2] (sр3‑гибридизация), содержит ковалентные σ‑связи S – ОН и σπ‑связи S=O. Ион SO42‑ имеет правильно‑тетраэдрическое строение [S(O)4]. Обладает широким температурным интервалом жидкого состояния (~300 градусов). При нагревании выше 296 °C частично разлагается. Перегоняется в виде азеотропной смеси с водой (массовая доля кислоты 98,3 %, температура кипения 296–340 °C), при более сильном нагревании разлагается полностью. Неограниченно смешивается с водой (с сильным экзо‑эффектом). Сильная кислота в растворе, нейтрализуется щелочами и гидратом аммиака. Переводит металлы в сульфаты (при избытке концентрированной кислоты в обычных условиях образуются растворимые гидросульфаты), но металлы Be, Bi, Со, Fe, Mg и Nb пассивируются в концентрированной кислоте и не реагируют с ней. Реагирует с основными оксидами и гидроксидами, разлагает соли слабых кислот. Слабый окислитель в разбавленном растворе (за счет НI), сильный – в концентрированном растворе (за счет SVI). Хорошо растворяет SO3 и реагирует с ним (образуется тяжелая маслообразная жидкость – олеум, содержит H2S2O7).
Качественная реакция на ион SO42‑ – осаждение белого сульфата бария BaSO4 (осадок не переводится в раствор соляной и азотной кислотами, в отличие от белого осадка BaSO3).
Применяется в производстве сульфатов и других соединений серы, минеральных удобрений, взрывчатых веществ, красителей и лекарственных препаратов, в органическом синтезе, для «вскрытия» (первого этапа переработки) промышленно важных руд и минералов, при очистке нефтепродуктов, электролизе воды, как электролит свинцовых аккумуляторов. Ядовита, вызывает ожоги кожи. Уравнения важнейших реакций:
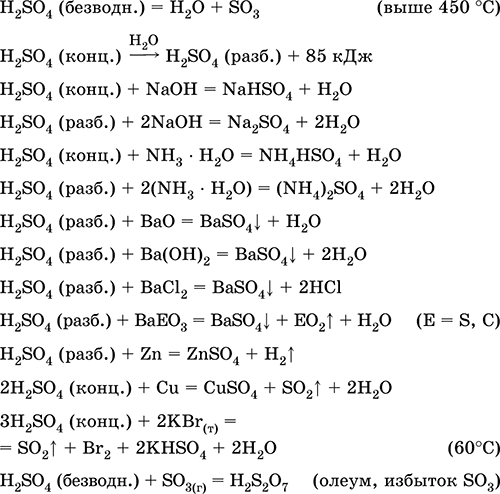
Получение в промышленности
:
а) синтез SO2 из серы, сульфидных руд, сероводорода и сульфатных руд:
S + O2 (воздух) = SO2
(280–360 °C)
4FeS2 + 11O2 (воздух) = 8SO2
+ 2Fe2O3 (800 °C, обжиг)
2H2S + 3O2 (изб.) = 2SO2
+ 2Н2O (250–300 °C)
CaSO4 + С (кокс) = СаО + SO2
+ СО (1300–1500 °C)
б) конверсия SO2 в SO3 в контактном аппарате:
![]()
в) синтез концентрированной и безводной серной кислоты:
Н2O (разб. H2SO4) + SO3 = H2SO4
(конц., безводн.)
(поглощение SO3 чистой водой с получением H2SO4 не проводится из‑за сильного разогревания смеси и обратного разложения H2SO4, см. выше);
г) синтез олеума – смеси безводной H2SO4, дисерной кислоты H2S2O7 и избыточного SO3. Растворенный SO3 гарантирует безводность олеума (при попадании воды тут же образуется H2SO4), что позволяет безопасно перевозить его в стальных цистернах.
Сульфат натрия Na2SO4.
Оксосоль. Белый, гигроскопичный. Плавится и кипит без разложения. Образует кристаллогидрат (минерал мирабилит), легко теряющий воду; техническое название глауберова соль. Хорошо растворим в воде, не гидролизуется. Реагирует с H2SO4 (конц.), SO3. Восстанавливается водородом, коксом при нагревании. Вступает в реакции ионного обмена.
Применяется в производстве стекла, целлюлозы и минеральных красок, как лекарственное средство. Содержится в рапе соляных озер, в частности в заливе Кара‑Богаз‑Гол Каспийского моря.
Уравнения важнейших реакций:
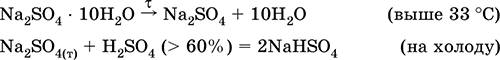
Смотрите также
Серебро: свойства и сферы применения
Серебро,
по латыни Argentum, Ag. Самородное серебро было известно в глубокой древности
(4-е тыс. до н. э.) в Египте, Персии, Китае. Это химический элемент I группы
периодической системы Мен ...
Турбидиметрический и нефелометрический методы анализа объектов окружающей среды
В аналитической
химии часто приходится сталкиваться с определением малых количеств (следов)
веществ. Например, содержание примесей в чистых металлах исчисляется тысячными
долями процента. С ...
Периодическая система элементов Менделеева
Периодический
закон и Периодическая система химических элементов Д. И. Менделеева – основа
современной химии. Они относятся к таким научным закономерностям, которые
отражают явления, реальн ...


