Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Диоксид серы. СульфитыCправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Cправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Диоксид серы. Сульфиты Диоксид серы. Сульфиты
Диоксид серы SO2.
Кислотный оксид. Бесцветный газ с резким запахом. Молекула имеет строение незавершенного треугольника [: S(O)2] (sр2‑гибридизация), содержит σ,π‑связи S=O. Легко сжижается, термически устойчивый. Хорошо растворим в воде (~40 л/1 л Н2O при 20 °C). Образует полигидрат, обладающий свойствами слабой кислоты, продукты диссоциации – ионы HSO3‑ и SO32‑. Ион HSO3‑ имеет две таутомерные формы – симметричную
(некислотную) со строением тетраэдра [S(H)(O)3] (sр3‑гибридизация), которая преобладает в смеси, и несимметричную
(кислотную) со строением незавершенного тетраэдра [: S(O)2(OH)] (sр3‑гибридизация). Ион SO32‑ также тетраэдрический [: S(O)3].
Реагирует со щелочами, гидратом аммиака. Типичный восстановитель, слабый окислитель.
Качественная реакция – обесцвечивание желто‑коричневой «йодной воды». Промежуточный продукт в производстве сульфитов и серной кислоты.
Применяется для отбеливания шерсти, шелка и соломы, консервирования и хранения фруктов, как дезинфицирующее средство, антиоксидант, хладагент. Ядовит.
Соединение состава H2SO3 (сернистая кислота) не известно (не существует).
Уравнения важнейших реакций:
![]()
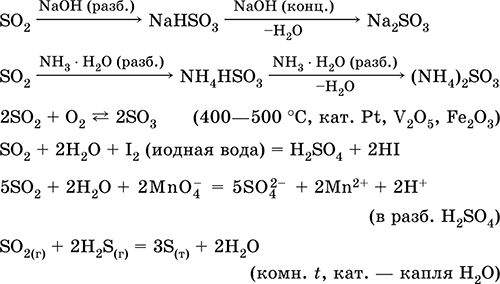
Растворение в воде и кислотные свойства:
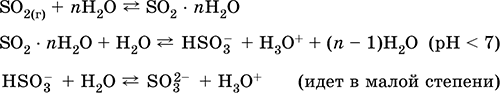
Получение: в промышленности – сжигание серы в воздухе, обогащенном кислородом, и, в меньшей степени, обжиг сульфидных руд (SO2 – попутный газ при обжиге пирита):
S + O2 = SO2
(280–360 °C)
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
(800 °C, обжиг)
в лаборатории – вытеснение серной кислотой из сульфитов:
BaSO3(т) + H2SO4 (конц.) = BaSO4↓ + SO2↑ + Н2O
Сульфит натрия Na2SO3.
Оксосоль. Белый. При нагревании на воздухе разлагается без плавления, плавится под избыточным давлением аргона. Во влажном состоянии и в растворе чувствителен к кислороду воздуха. Хорошо растворим в воде, гидролизуется по аниону. Разлагается кислотами. Типичный восстановитель.
Качественная реакция на ион SO32‑ – образование белого осадка сульфита бария, который переводится в раствор сильными кислотами (НCl, HNO3).
Применяется как реактив в аналитической химии, компонент фотографических растворов, нейтрализатор хлора при отбеливании тканей.
Уравнения важнейших реакций:
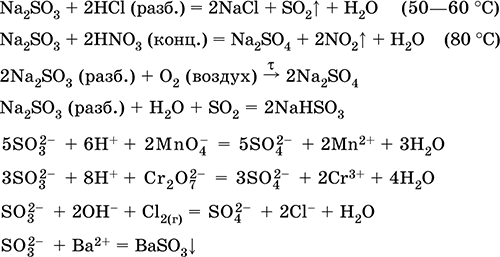
Получение:
Na2CO3 (конц.) + SO2 = Na2SO3+ CO2↑
Смотрите также
Силикагель и его применение в высокоэффективной жидкостной хроматографии
В современной промышленности и науке особое место среди сорбентов
принадлежит силикагелю, представляющему собой высушенный гель кремниевой кислоты.
По масштабам применения силикагель существ ...
имическая сборка поверхности твердых тел путем молекулярного наслаивания
Получение принципиально новых характеристик
материалов и изделий, особенно при создании искусственных структур, основанных
на квантовых эффектах [1-6], невозможно в перспективе без создания ...


