Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Халькогены. КислородCправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Cправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Халькогены. Кислород Халькогены. КислородСтраница 1
Кислород – элемент 2‑го периода и VIA‑группы Периодической системы, порядковый номер 8, относится к халькогенам (но чаще рассматривается отдельно). Электронная формула атома [2He]2s22p4, характерные степени окисления чаще 0 и – II, реже – I и +II, состояние ОII считается устойчивым.
Шкала степеней окисления кислорода:
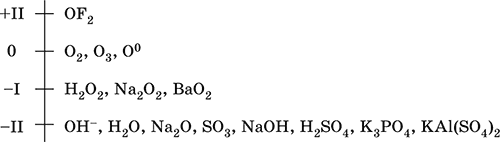
Кислород обладает высокой электроотрицательностью (3,50, второй элемент после фтора), проявляет типичные неметаллические свойства. Образует соединения со всеми элементами, кроме Не, Ne и Ar, входит в состав многочисленных оксидов, гидроксидов, солей кислородсодержащих кислот.
Природный кислород содержит изотоп 16O с примесью изотопов 17O и 18O. В химии большинство соединений природного кислорода рассматривается как изотопно‑чистые соединения кислорода‑16.
Кислород – самый распространенный элемент в земной коре (55 %) и природных водах, встречается в свободном и связанном виде. Жизненно важный элемент для всех организмов.
Кислород O2.
Простое вещество. Состоит из неполярных молекул О2 (дикислород) с σπ‑связью O=O, устойчивая аллотропная форма существования элемента в свободном виде. Бесцветный газ, в жидком состоянии – светло‑голубой, в твердом – синий.
Составная часть воздуха: 20,94 % по объему, 23,13 % по массе. Из жидкого воздуха кислород выкипает послеазота N2. Малорастворим в воде (31 мл/1 л Н2O при 20 °C), но несколько лучше, чем N2. При комнатной температуре обладает малой химической активностью из‑за прочности двойной связи в молекулах.
Кислород поддерживает горение многих веществ. Сильный окислитель при высоких температурах, реагирует с большинством металлов и неметаллов:

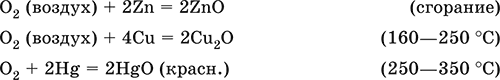
Кислород вызывает ржавление (медленное окисление) железа, уравнения реакций см. в 11.3. Особенно активен атомарный кислород О0 (активность выше, чем у озона O3), обычно получаемый непосредственно в зоне реакции при термическом разложении многих веществ.
Простейшая качественная реакция – яркое загорание тлеющей древесной лучинки в атмосфере кислорода.
Получение кислорода:
а) в промышленности
– фракционная дистилляция жидкого воздуха, электролиз воды (уравнения реакций см. в разд. 12);
б) в лаборатории
– нагревание легко разлагающихся кислородсодержащих веществ:
2HgO = 2Hg + O2 (450–500 °C)
2КMnO4 = К2MnO4 + MnO2 + O2 (200–240 °C)
2Na2O2 = 2Na2O + O2 (400–675 °C, вакуум)
2КClO3 = 2КCl + 3O2 (150–300 °C, кат. MnO2)
2KNO3 = 2KNO2 + O2 (400–520 °C)
Кислород является важнейшим продуктом основного химического производства. Применяется как реагент в химической технологии (обжиг сульфидных руд, синтез оксидов), металлургии (производство чугуна и стали) и газификации природного угля, при сварке и резке металлов; жидкий кислород – окислитель топлива в ракетной технике.
Убыль кислорода в атмосфере в результате процессов горения, гниения и дыхания возмещается растениями при фотосинтезе. При вдыхании человеком и животными воздуха в легкие кислород связывается с гемоглобином крови и переносится в клетки, где органические вещества (в первую очередь глюкоза) с его помощью окисляются и обеспечивают жизненную энергию организмов.
Озон O3.
Простое вещество (трикислород), неустойчивая аллотропная форма существования элемента. Светло‑синий газ с характерным («озоновым») запахом, тяжелее воздуха. Молекула имеет строение незавершенного треугольника [: O(O)2] (sр2‑гибридизация, валентный угол 117°), содержит ковалентные σπ‑связи O=O. Разлагается под действием ультрафиолетового излучения, катализаторов и оксидов азота (разрушение озонового слоя атмосферы Земли). Устойчив в смеси с O2 (озонированный кислород). Малорастворим в воде (285 мл/1 л Н2O), но значительно лучше, чем O2. Сильный окислитель (более сильный, чем O2, но более слабый, чем атомарный кислород O0). Окисляет при комнатной температуре многие металлы и неметаллы до высоких степеней окисления. С надпероксидами щелочных металлов (К, Rb, Cs) образует оранжево‑красные озониды. Не реагирует с Au, Cu, Ni, Pt, Sn. Генерируется из кислорода O2 в специальном приборе – озонаторе.
Качественная реакция – выделение иода из раствора KI при комнатной температуре (O2 в реакцию не вступает). Уравнения важнейших реакций:
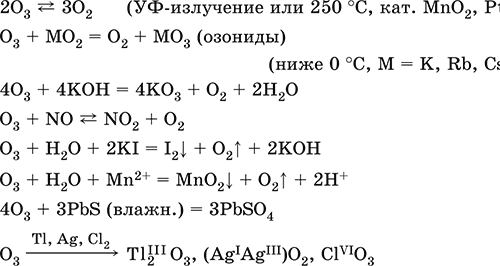
Получение: под действием электрического разряда в озонаторе:
![]()
Смотрите также
Ультрафиолетовое отверждение лаков и красок
На сегодняшний
момент в различных областях науки и промышленности ведутся активные
исследования, направленные на создание ресурсо- и энергосберегающих
экологически безопасных технологий. В ...
Монокристаллический кремень
Основной объем
монокристаллического кремния (80-90%) потребляемого электронной
промышленностью, выращивается по методу Чохральского.
Фактически весь кремний,
используемый для производст ...
Приготовление сорбентов и колонок для высокоэффективной жидкостной хроматографии
...


