Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Изобарно-изотермический потенциалСтатьи и работы по химии / Статьи и работы по химии / Изобарно-изотермический потенциал Изобарно-изотермический потенциалСтраница 2
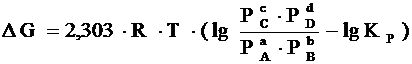 ,
,
где Р А, Р В, Р С, Р D – парциальные давления исходных веществ и продуктов реакции.
Два последних уравнения называются уравнениями изотермы химической реакции Вант-Гоффа. Это соотношение позволяет рассчитать значения D G и D F реакции, определить ее направление при различных концентрациях исходных веществ.
Необходимо отметить, что как для газовых систем, так и для растворов, при участии в реакции твердых тел (т.е. для гетерогенных систем) концентрация твердой фазы не входит в выражение для константы равновесия, поскольку эта концентрация практически постоянна. Так, для реакции
2 СО (г) = СО 2 (г) + С (т)
константа равновесия записывается в виде
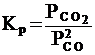 .
.
Зависимость константы равновесия от температуры (для температуры Т2 относительно температуры Т1) выражается следующим уравнением Вант-Гоффа:
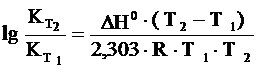 ,
,
где D Н0 – тепловой эффект реакции.
Для эндотермической реакции (реакция идет с поглощением тепла) константа равновесия увеличивается с повышением температуры, система как бы сопротивляется нагреванию.
33. Эбулиоскопическая константа воды равна 0,512. Рассчитать, при какой температуре кипит 5 %-ный раствор сахарозы в воде.
Решение.
Повышение температуры кипения раствора
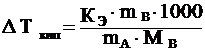
![]() г/моль
г/моль
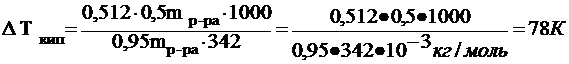
Температура кипения Т = То +DТкип=373 К+78К=451К
59. Свойства дисперсных систем и растворов ВМС, их сходство и отличие. Пояснить, какими путями можно перейти от истинного раствора ВМС к дисперсной системе.
Основными отличительными особенностями дисперсных систем являются:
а) способность к рассеиванию ими света;
б) медленная диффузия частиц дисперсной фазы в дисперсионной среде;
в) способность к диализу;
г) агрегативная неустойчивость дисперсной фазы, которая определяется выделением частиц из дисперсионной среды при добавлении к системе электролитов или под влиянием других внешних воздействий.
Понятие агрегатного состояния не применимо к ВМС, применяется понятие фазового (в структурном смысле) состояния. По сути, понятие фазового состояния характеризует порядок взаимного расположения молекул: ВМС могут находиться в кристаллическом, аморфном и, чрезвычайно редко, в газообразном фазовом состояниях, причем наиболее типичным является аморфное состояние. Последнее дополнительно подразделяется на стеклообразное, высокоэластическое и вязкотекучее. Переход из одного состояния в другое всегда протекает не резко, а в некотором интервале температур.
При помещении ВМС в растворитель происходит поглощение растворителя и соответствующее увеличение объема и массы полимера, идет процесс набухания.
Если каким-либо способом воспрепятствовать увеличению объема ВМС при его набухании, то со стороны ВМС может проявляться чрезвычайно высокое давление набухания, достигающее нескольких атмосфер (пример – дробление скал древесными клиньями, заливаемыми водой).
Процесс набухания высокомолекулярного вещества связан с взаимодействием макромолекул с молекулами растворителя, и степень набухания ВМС зависит как от природы ВМС, так и от природы растворителя. Набухание полярного ВМС протекает только в полярном растворителе, а неполярного – только в неполярном (полезно вспомнить эмпирическое правило: подобное растворяется в подобном).
Смотрите также
Физико-химические методы анализа веществ
В практической
деятельности часто возникает необходимость идентификации (обнаружения) того или
иного вещества, а также количественной оценки (измерения) его содержания.
Химическая
иденти ...
Огнестойкие композиции на основе полибутилентерефталата
"В химии нет отходов, есть только
неиспользованное сырье" Д. И. Менделеев.
Как известно, развитие современной техники
невозможно без исследования пластических масс, в особенност ...


