Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Производство сталиCправочник по химии для подготовки к ЕГЭ / Переходные металлы 4‑го периода. Свойства, способы получения.
Общие свойства металлов / Cправочник по химии для подготовки к ЕГЭ / Переходные металлы 4‑го периода. Свойства, способы получения.
Общие свойства металлов / Производство стали Производство сталиСтраница 2
Уравнения важнейших реакций:
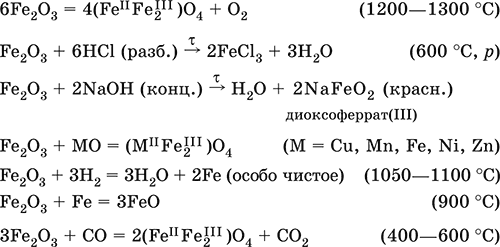
Получение в лаборатории– термическое разложение солей железа(III) на воздухе:
Fe2(SO4)3 = Fe2O3 + 3SO3 (500–700 °C)
4{Fe(NO3)3 9 H2O} = 2FeaO3 + 12NO2 + 3O2 + 36H2O (600–700 °C)
В природе – оксидные руды железа гематит Fe2O3 и лимонит Fe2O3 nН2O.
Гидроксид железа (II) Fe(OH)2.
Амфотерный гидроксид с преобладанием основных свойств. Белый (иногда с зеленоватым оттенком), связи Fe – ОН преимущественно ковалентные. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа. Применяется в изготовлении активной массы железоникелевых аккумуляторов.
Уравнения важнейших реакций:
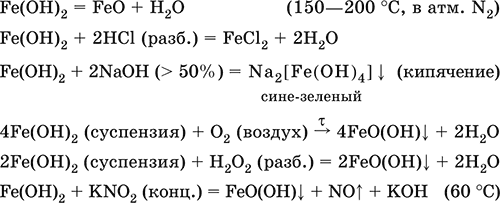
Получение: осаждение из раствора щелочами или гидратом аммиака в инертной атмосфере:
Fe2+ + 2OН(разб.) = Fe(OH)2↓
Fe2+ + 2(NH3 H2O) = Fe(OH)2
↓ + 2NH4+
Метагидроксид железа FeO(OH).
Амфотерный гидроксид с преобладанием основных свойств. Светло‑коричневый, связи Fe – О и Fe – ОН преимущественно ковалентные.
При нагревании разлагается без плавления. Нерастворим в воде. Осаждается из раствора в виде бурого аморфного полигидрата Fe2O3 nН2O, который при выдерживании под разбавленным щелочным раствором или при высушивании переходит в FeO(OH). Реагирует с кислотами, твердыми щелочами. Слабый окислитель и восстановитель. Спекается с Fe(OH)2. Промежуточный продукт при ржавлении железа. Применяется как основа желтых минеральных красок и эмалей, поглотитель отходящих газов, катализатор в органическом синтезе.
Соединение состава Fe(OH)3 не известно (не получено).
Уравнения важнейших реакций:
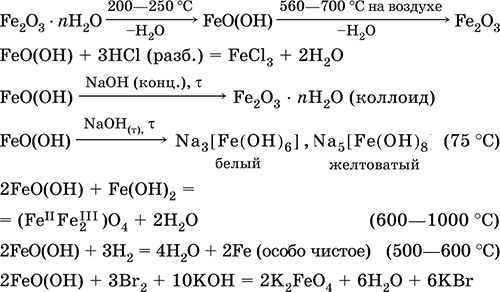
Получение: осаждение из раствора солей железа(III) гидрата Fe2O3 nН2O и его частичное обезвоживание (см. выше).
В природе – оксидная руда железа лимонит Fe2O3 nН2O и минерал гётит FeO(OH).
Феррат калия K2FeO4.
Оксосоль. Красно‑фиолетовый, разлагается при сильном нагревании. Хорошо растворим в концентрированном растворе КОН, реагирует с кипящей водой, неустойчив в кислотной среде. Сильный окислитель. Качественная реакция – образование красного осадка феррата бария. Применяется в синтезе ферритов – промышленно важных двойных оксидов железа (III) и других металлов.
Уравнения важнейших реакций:
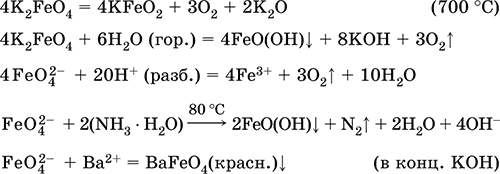
Получение: образуется при окислении соединений железа, например метагидроксида FeO(OH), бромной водой, а также при действии сильных окислителей (при спекании) на железо
Fe + 2KOH + 2KNO3 = K2FeO4+ 3KNO2 + H2O (420 °C)
и электролизе в растворе:
![]()
(феррат калия образуется на аноде).
Качественные реакции на ионы Fe2+ и Fe3+.Обнаружение ионов Fe2+ и Fe3+ в водном растворе проводят с помощью реактивов K3[Fe(CN)6] и K4[Fe(CN)6] соответственно; в обоих случаях выпадает синий продукт одинакового состава и строения, KFeIII[FeII(CN)6]. В лаборатории этот осадок называют берлинская лазурь, или турнбуллева синь:
Смотрите также
Углеводы как главный источник энергии в организме человека
...
Определение состава стиральных порошков
Ещё лет
10-15 назад название используемых синтетических моющих средств (СМС), в особенности
стиральных порошков можно было легко перечислить: Астра, Эра, Лотос, так как их
набор не отличалс ...
Огнестойкие композиции на основе полибутилентерефталата
"В химии нет отходов, есть только
неиспользованное сырье" Д. И. Менделеев.
Как известно, развитие современной техники
невозможно без исследования пластических масс, в особенност ...


