Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
АлюминийCправочник по химии для подготовки к ЕГЭ / Металлы главных подгрупп I–III групп / Cправочник по химии для подготовки к ЕГЭ / Металлы главных подгрупп I–III групп / Алюминий АлюминийСтраница 2
Уравнения важнейших реакций:
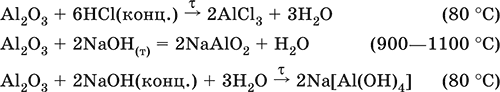
(эта реакция используется для «вскрытия» бокситов)
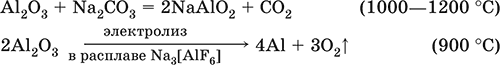
В природе входит в состав глины и бокситов, образует минерал корунд.
Гидроксид алюминия Al(ОН)3.
Амфотерный гидроксид, кислотные и основные свойства равно выражены. Белый, аморфный (гелеобразный) или кристаллический. Связи Al – ОН преимущественно ковалентные. Разлагается при нагревании без плавления. Практически не растворяется в воде. Реагирует с кислотами, щелочами в растворе и при сплавлении. Не реагирует с NH3 Н2O, NH4Cl, СO2, SO2 и H2S. Метагидроксид АlO(ОН) химически менее активен, чем Al(ОН)3. Промежуточный продукт в производстве алюминия. Применяется для синтеза других соединений алюминия (в том числе криолита), органических красителей, как лекарственный препарат при повышенной кислотности желудочного сока.
Уравнения важнейших реакций:
• термическое разложение
![]()
• основная и кислотная диссоциация в растворе
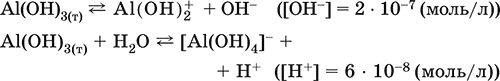
(реакции характеризуют очень малую растворимость в воде и амфотерность гидроксида, поставляющего в раствор одновременно ионы ОН и Н+ примерно в равной концентрации; гидроксид диссоциирует слабее, чем сама вода)
• амфотерные свойства
Al(ОН)3 + ЗНСlразб.) = AlCl3 + ЗН2O
Al(ОН)3 + NaOH(т) = NaAlO2 + 2Н2O (1000 °C)
Al(ОН)3 + NaOH(конц.) = Na[Al(OH)4](p)
Для получения осадка Al(ОН)3 щелочь обычно не используют из‑за легкости перехода осадка в раствор (см. выше), а действуют на соли алюминия гидратом аммиака. При комнатной температуре образуется Al(ОН)3, а при кипячении – менее активный АlO(ОН):
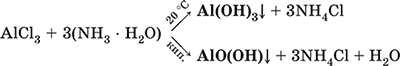
Удобный способ получения Al(ОН)3 – пропускание СO2 через раствор гидроксокомплекса:
[Al(ОН)4]‑ + СO2 = Al(ОН)3↓ +
HCO3‑
Тетрагидроксоалюминат(III) натрия Na[Al(OH)4].
Комплексная соль. С таким составом существует при комнатной температуре в концентрированном растворе NaOH. Для твердого состояния состав условный, так как при кристаллизации из раствора он усложняется (выделены Na4[Al(OH)7], Na4[Al4O3(OH)10] и др.). При прокаливании твердые соли разлагаются до диоксоалюмината(III) натрия NaAlO2, при разбавлении их растворов – до Al(ОН)3. По‑разному реагируют с сильными и слабыми кислотами, с хлоридом алюминия и карбонатом аммония.
Уравнения важнейших реакций:
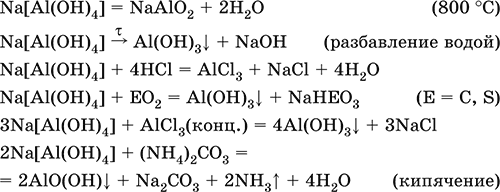
Получение: взаимодействие Al(ОН)3 и солей алюминия с NaOH в концентрированном растворе:
Al(OH)3 + NaOH(конц.) = Na[Al(OH)4]
AlCl3 + 4NaOH(конц.) = Na[Al(OH)4]
+ 3NaCl
Образуется из оксида алюминия (см.) как промежуточный продукт при промышленном «вскрытии» бокситов.
Примеры заданий части А
1. Среди металлов главной подгруппы II группы наиболее сильным
восстановителем является
1) барий
2) кальций
3) стронций
4) магний
2. При сжигании магния на воздухе образуются
Смотрите также
Железо
В периодической системе
железо находится в четвертом периоде, в побочной подгруппе VIII группы.
Химический знак – Fe (феррум). Порядковый
номер – 26, электронная формула 1s2 2s2 2p6
3d6 ...
Введение.
В связи с возрастающим применением РЗМ и
различных материалов на их основе и с добавками редкоземельных металлов в
различных областях науки и техники, в частности, в химической,
металлургической, ...
Реакции a-литиированных циклических нитронов с электрофильными реагентами
...


