Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
НатрийCправочник по химии для подготовки к ЕГЭ / Металлы главных подгрупп I–III групп / Cправочник по химии для подготовки к ЕГЭ / Металлы главных подгрупп I–III групп / Натрий НатрийСтраница 2
2Na2O2 = 2Na2O + O2 (400–675 °C, вакуум)
Na2O2 + 2Н2O = Н2O2 + 2NaOH (на холоду)
2Na2O2 + 2Н2O = O2↑ + 4NaOH (кипячение)
Na2O2 + 2НCl (разб.) = 2NaCl + Н2O2 (на холоду)
2Na2O2 + 4НCl (разб.) = 4НCl + 2Н2O + O2↑ (кипячение)
2Na2O2 + 2CO2 = Na2CO3 + O2
Na2O2 + CO = Na2CO3
Na2O2 + 4H+ + 2I‑ = I2↓ + 2H2O + 2Na+
5Na2O2 + 16H+ + 2MnO4‑ = 5O2↑ + 2Mn2+ + 8H2O + 10Na+
3Na2O2 + 2[Cr(OH)6]3‑ = 2CrO24‑ + 8OH‑ + 2H2O + 6Na+ (80 °C)
Получение: сжигание Na на воздухе.
Гидроксид натрия NaOH.
Основный гидроксид, щелочь, техническое название едкий натр. Белые кристаллы с ионным строением (Na+)(OH‑). Расплывается на воздухе, поглощая влагу и углекислый газ (образуется NaHCO3). Плавится и кипит без разложения. Вызывает тяжелые ожоги кожи и глаз.
Хорошо растворим в воде (с экзо‑эффектом, +56 кДж). Реагирует с кислотными оксидами, нейтрализует кислоты, вызывает кислотную функцию у амфотерных оксидов и гидроксидов:
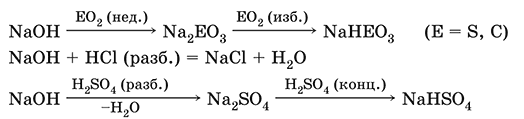
NaOH (разб.) + H3PO4 (конц.) = NaH2PO4 + H2O
2NaOH (разб.) + H3PO4 (разб.) = Na2HPO4 + 2H2O
3NaOH (конц.) + H3PO4 (разб.) = Na3PO4 + 3H2O
2NaOH(T) + M2O3 = 2NaMO2 + H2O (1000 °C, M = Al, Cr)
2NaOH (конц.) + 3H2O + AI2O3 = 2Na[Al(OH)4] (кипячение)
2NaOH(T) + M(OH)2 = Na2MO2 + 2H2O (500 °C, M = Be, Zn)
2NaOH (конц.) + Zn(OH)2 = Na2[Zn(OH)4]
Осаждает нерастворимые гидроксиды:
2NaOH + MCl2 = 2NaCl + M(OH)2↓ (M = Mg, Cu)
Подвергает дисмутации галогены и серу:
2NaOH (конц., хол.) + Е2 = NaE + NaEO + H2O (Е = Cl, Br)
6NaOH (разб., гор.) + 3S = 2Na2S + Na2SO3 + 3H2O
Подвергается электролизу в расплаве:
![]()
Раствор NaOH разъедает стекло (образуется NaSiO3), корродирует поверхность алюминия (образуются Na[Al(OH)4] и Н2).
Получение NaOH в промышленности
:
а) электролиз раствора NaCl на инертном катоде:
![]()
б) электролиз раствора NaCl на ртутном катоде (амальгамный способ):
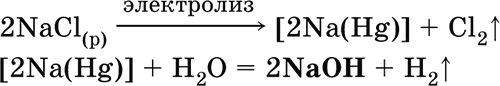
(освобождающуюся ртуть возвращают в электролизер).
Едкий натр – важнейшее сырье химической промышленности. Используется для получения солей натрия, целлюлозы, мыла, красителей и искусственного волокна; как осушитель газов; реагент в извлечении из вторичного сырья и очистке олова и цинка; при переработке руд алюминия (бокситов).
Смотрите также
Разработка дополнительных занятий в школе к теме "Химизм различных способов приготовления пищи"
Проблема пищи всегда
была одной из самых важных проблем, стоящих перед человеческим обществом.
Все, кроме кислорода,
человек получает для своей жизнедеятельности из пищи. Среднее потребле ...
Железо в почвах. Методы определения железа
Железо — элемент, абсолютно необходимый для жизни растений,
без железа не образуется хлорофилла. В почвах железо встречается в составе
минералов группы ферросиликатов, в виде гидроокислов, о ...
Атомно-абсорбционный анализ
Многие тяжелые металлы, такие как железо, медь, цинк,
молибден, участвуют в биологических процессах и в определенных количествах
являются необходимыми для функционирования растений, животных ...


