Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Электронные формулы элементовОткрытая химия / Электронное строение атомов / Открытая химия / Электронное строение атомов / Электронные формулы элементов Электронные формулы элементов
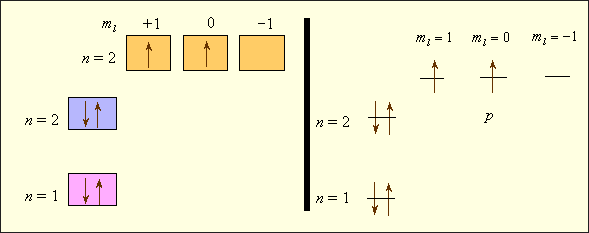
Рассмотрим последовательное заполнение электронных оболочек атомов в соответствии с приведенными правилами. В записи электронных формул (или конфигураций), отражающих эту последовательность, первая цифра равна n, буква после нее соответствует l, а правый верхний индекс равен числу электронов в этом состоянии (табл. 2.1). Например, электронная формула лития – 1s22s1, углерода – 1s22s22p2, хлора – 1s22s22p63s23p5. Заселенность электронных оболочек может быть представлена в виде квантовых ячеек (квадратов или горизонтальных линий) (рис. 2.2). В отличие от электронных формул, здесь используются не два, а все четыре квантовых числа. Видно, что энергия электронов в многоэлектронных атомах определяется как квантовым числом n, так и l; электроны отличаются значениями ml, а у спаренных электронов различны только спины. Свободная ячейка в нашем примере означает свободную p-орбиталь, которую может занимать электрон при возбуждении атома.
 |
|
Рисунок 2.2 Электронное строение атома углерода |
Смотрите также
Автоматизация процесса прокалки кокса
Прокаленный кокс используется для изготовления
электродов, применяемых в электролизерах для электролиза алюминия. Кокс
прокаливается с целью удаления влаги и летучих компонентов для улучшени ...
Задание
При исследовании
кинетики реакции: PhNH2 (A1) + PhC ≡ CH (A2)→ PhNC(Ph)=CH2 (A3)
в растворе хлорбензола реализован следующий
эксперимент (400С):
В опытах получены
следующие завис ...


