Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Реакции
обмена в растворах электролитов и условия их протекания.
Ионные уравнения.Статьи и работы по химии / Дисперсные системы, электролиты, РН показатель / Статьи и работы по химии / Дисперсные системы, электролиты, РН показатель / Реакции
обмена в растворах электролитов и условия их протекания.
Ионные уравнения. Реакции
обмена в растворах электролитов и условия их протекания.
Ионные уравнения.Страница 1
Таким образом, реакции нейтрализации любой сильной кислоты любым сильным основанием сводится к одному и тому же процессу – к образованию молекул воды из ионов водорода и гидроксид-ионов. Ясно, что тепловые эффекты этих реакций тоже должны быть одинаковы.
Строго говоря, реакция образования воды из ионов обратима, что можно выразить уравнением:
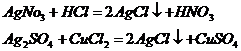 При смешивании раствора какой-либо соли серебра с соляной кислотой или с раствором любой её соли всегда образуется характерный белый творожистый осадок хлорида серебра:
При смешивании раствора какой-либо соли серебра с соляной кислотой или с раствором любой её соли всегда образуется характерный белый творожистый осадок хлорида серебра:
![]() Подобные реакции также сводятся к одному процессу. Для того чтобы получить его ионно-молекулярное уравнение, перепишем уравнение первой реакции, записывая сильные электролиты в ионной форме а вещество, находящееся в осадке, в молекулярной:
Подобные реакции также сводятся к одному процессу. Для того чтобы получить его ионно-молекулярное уравнение, перепишем уравнение первой реакции, записывая сильные электролиты в ионной форме а вещество, находящееся в осадке, в молекулярной:
![]() Как видно, ионы Н+ и NО3- не претерпевают изменений в ходе реакции. Поэтому исключим их и перепишем уравнение ещё раз:
Как видно, ионы Н+ и NО3- не претерпевают изменений в ходе реакции. Поэтому исключим их и перепишем уравнение ещё раз:
Это и есть ионно-молекулярное уравнение рассматриваемого процесса.
Однако, вследствие малой растворимости хлорида серебра, это равновесие очень сильно смещено вправо. Поэтому можно считать, что реакция образования AgCl из ионов практически доходит до конца.
Для составления ионно-молекулярных уравнений необходимо знать, какие соли растворимы в воде и какие практически нерастворимы.
Смотрите также
Коагулирование примесей воды
...
Лигандообменная хроматография
Лигандообменная хроматография
основана на образовании координационных связей между сорбентом и разделяемыми
ионами или молекулами. Лигандообменная хроматография применима только для
разделе ...
Синтез 4-бром-4’-гидроксибифенила
Настоящая работа посвящена синтезу 4-бром-4’-гидроксибифенила. Это
соединение является важным реагентом для синтеза ферроценсодержащих жидких
кристаллов. Введение в молекулу ферроцена бифени ...


