Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Белки
Белки – высокомолекулярные соединения, образующиеся в результате связывания отдельных полипептидных цепей водородными связями. Все белки подразделяются на глобулярные и фибриллярные. Глобулярные белки компактны, обладают сферической и приближенными к ней формами. Глобулярный белок диаметром 2,5 нм представляет собой полипептидную цепь длиной до 50 нм, свернутую в клубок. Фибриллярные белки обычно вытянуты и входят в состав тканей, мышц, волос. Полипептидные цепи такого белка, свернутые в винтовую спираль, ориентированы параллельно друг другу. На рис. 13.3 приведена структура нити мышечного белка. Одной из важнейших вторичных структур является α-спираль, впервые найденная Л. Полингом и Р. Б. Кори.
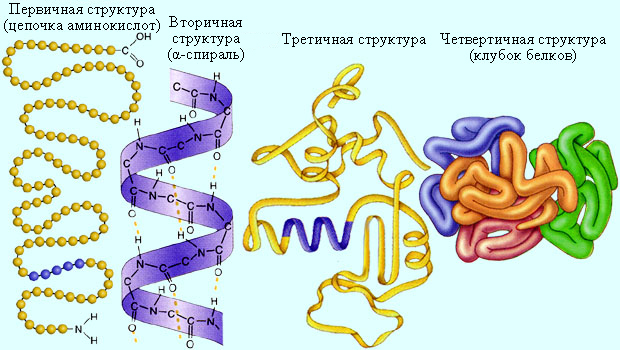 |
|
Рисунок 13.3 Структура нити мышечного белка |
Белковую природу имеют многочисленные ферменты, которые катализируют реакции определенного типа. Ферментам свойственна высокая избирательность, наибольшая активность при нормальной температуре организма, зависимость ферментной активности от pH. Ферменты разделяются на шесть классов:
1. Оксидоредуктазы – катализируют окислительно-восстановительные процессы.
2. Трансферазы – катализируют перенос химических групп (радикалов).
3. Гидролазы – катализируют гидролитические процессы.
4. Лиазы – обеспечивают присоединение по двойным связям или их образование.
5. Изомериазы – участвуют в процессах изомеризации.
6. Синтетазы – обеспечивают реакции конденсации двух молекул с участием фосфатных групп.
Для обеспечения каталитической функции многие ферменты содержат в молекуле небелковую часть – кофактор. Кофакторами могут быть органические вещества или ионы биометаллов, а также ![]()
Смотрите также
Вулканизация каучуков
Фторкаучуки вулканизуются
при нагревании смесей, содержащих вулканизующие агенты, или под действием
излучений высокой энергии. Степень радиационной вулканизации фторкаучуков тем
выше, чем больше со ...
Исследование совместного электровосстановление гадолиния и криолита в галогенидных расплавах
...


