Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кислотно-основной катализСтатьи и работы по химии / Гомогенный катализ / Статьи и работы по химии / Гомогенный катализ / Кислотно-основной катализ Кислотно-основной катализСтраница 1
Гомогенных каталитических реакций в растворах, ускоряемых ионами гидроксила и водорода, довольно много. К реакциям этого типа относятся этерификация кислот и спиртов, инверсия сахаров, галоидирование соединений, содержащих карбонильную группу, омыление сложных эфиров и др.
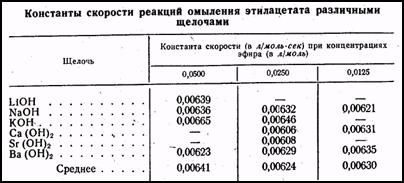 Таким образом, в этом случае ион гидроксила одновременно является и одним из исходных веществ, и катализатором. В табл. 2 приведены константы скорости реакций омыления этилацетата в растворах гидроокисей некоторых металлов. Из таблицы видно, что константа скорости практически не зависит от начальной концентрации эфира и от химической природы
Таким образом, в этом случае ион гидроксила одновременно является и одним из исходных веществ, и катализатором. В табл. 2 приведены константы скорости реакций омыления этилацетата в растворах гидроокисей некоторых металлов. Из таблицы видно, что константа скорости практически не зависит от начальной концентрации эфира и от химической природы
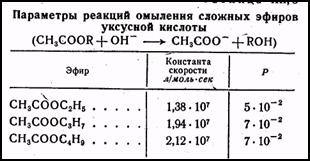 Изменение алкильного радикала в сложных эфирах уксусной кислоты также не изменяет константы скорости реакций и очень мало изменяет конфигурационные условия активного столкновения (табл.3). Из этих данных следует; что наиболее вероятен ионный механизм каталитического действия, и во всех случаях основная роль в активировании системы принадлежит ионам гидроксила. Аналогично этому при ускорении реакции путем добавления в раствор кислот каталитическая активность главным образом обусловлена ионами водорода.
Изменение алкильного радикала в сложных эфирах уксусной кислоты также не изменяет константы скорости реакций и очень мало изменяет конфигурационные условия активного столкновения (табл.3). Из этих данных следует; что наиболее вероятен ионный механизм каталитического действия, и во всех случаях основная роль в активировании системы принадлежит ионам гидроксила. Аналогично этому при ускорении реакции путем добавления в раствор кислот каталитическая активность главным образом обусловлена ионами водорода.
Еще Оствальд заметил, что для этой и аналогичных реакций между каталитической активностью системы и ее электропроводностью имеется однозначная связь. Аррениус подтвердил это и, кроме того, обнаружил, что во-первых, при добавлении к катализирующей реакцию кислоте ее соли, что согласно классической теории электролитической диссоциации должно уменьшить концентрацию ионов водорода, каталитический эффект не только не уменьшается, но в некоторых случаях даже возрастает (например, при этерификации трихлоруксусной кислоты). Это явление получило название вторичного солевого эффекта. Так как при добавлении к раствору кислоты ее соли увеличивается концентрация анионов и недиссоциированной кислоты, то из наличия солевого эффекта следует, что и недиссоциированная кислота, и ее анионы обладают каталитической активностью.
Во-вторых, Аррениус установил, что прибавление нейтральной соли, не имеющей общего иона с катализирующей реакцию кислотой, также приводит иногда к увеличению каталитического действия кислоты. Например, скорость инверсии тростникового сахара в присутствии уксусной кислоты возрастает на 30% при прибавлении 10% (мольных) NaCl. Это явление называется первичным солевым эффектом.
В некоторых случаях каталитическое ускорение реакции происходит только при одновременном присутствии в растворе кислоты и основания. Это наблюдается, например, для реакции мутаротации глюкозы, подробно изученной Лаури (1925).
Оказалось, что α-форма глюкозы, вращающая плоскость поляризации на 109,6°, в водном растворе быстро теряет оптическую активность, уменьшая угол вращения до 52,3°, вследствие частичного перехода в β-форму, вращающую плоскость лишь на 32°.


