Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кинетические уравнения каталитических процессов.Статьи и работы по химии / Гомогенный катализ / Статьи и работы по химии / Гомогенный катализ / Кинетические уравнения каталитических процессов. Кинетические уравнения каталитических процессов.
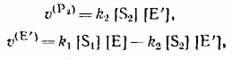 |
У четырех уравнений материального баланса, которые в замкнутой системе имеют вид:
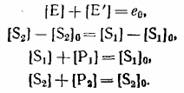 |
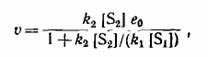 |
Т.е. первая стадия становится лимитирующей
Kм – сonst Михаэлиса, которая была впервые введена для реакций, катализируемых ферментами.
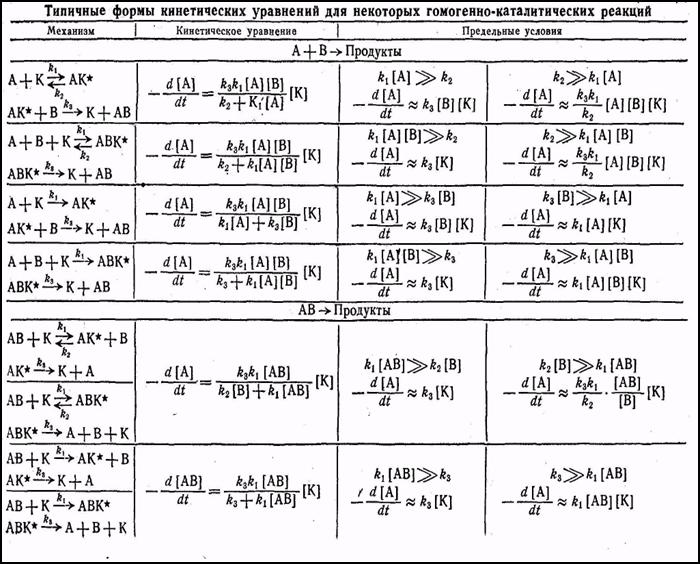 Уравнение Михаэлиса – широко используется прежде всего в реакциях, катализируемых ферментами, однако оно применимо к любой каталитической реакции, происходящей по механизму образования промежуточного комплекса катализатор-субстрат.
Уравнение Михаэлиса – широко используется прежде всего в реакциях, катализируемых ферментами, однако оно применимо к любой каталитической реакции, происходящей по механизму образования промежуточного комплекса катализатор-субстрат.
Смотрите также
Пептиды и первичная структура белка
Пептиды и белки
представляют собой высокомолекулярные органические соединения, построенные из
остатков α-аминокислот, соединенных между собой пептидными связями.
Ни один из
известны ...
Теория строения, многообразие, классификация и номенклатура
органических соединений. Типы химических реакций
Многообразие органических соединений, их свойств
и превращений объясняет теория химического строения (А. М. Бутлеров,
1861–1864).
Химическое строение – это определенная последовательность располо ...
Постановка задачи
Из
литературного обзора становится ясно, что получить на основе фуллеренов
ленгмюровские монослои достаточно сложно. Причины этого в том, что фуллерен
способен структурироваться. Так фуллерен С60 о ...


