Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Зависимость скорости химической реакции от температуры.
Правило Вант-Гоффа. Температурный коэффициент реакции.Статьи и работы по химии / Вычисление теплового эффекта реакций / Статьи и работы по химии / Вычисление теплового эффекта реакций / Зависимость скорости химической реакции от температуры.
Правило Вант-Гоффа. Температурный коэффициент реакции. Зависимость скорости химической реакции от температуры.
Правило Вант-Гоффа. Температурный коэффициент реакции.
К реакциям приводят только столкновения между активными молекулами, средняя энергия которых превышает среднюю энергию участников реакции.
При сообщении молекулам некоторой энергии активации Е (избыточная энергия над средней) уменьшается потенциальная энергия взаимодействия атомов в молекулах, связи внутри молекул ослабевают, молекулы становятся реакционноспособными.
Энергия активации не обязательно подводится извне, она может быть сообщена некоторой части молекул путем перераспределения энергии при их столкновениях. По Больцману, среди N молекул находится следующее число активных молекул N*, обладающих повышенной энергией :
N* = N·e – E / RT , (1)
где Е – энергия активации, показывающая тот необходимый избыток энергии, по сравнению со средним уровнем, которым должны обладать молекулы, чтобы реакция стала возможной; остальные обозначения общеизвестны.
При термической активации для двух температур T1 и T2 отношение констант скоростей будет:
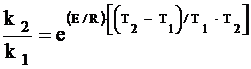 , (2)
, (2)
откуда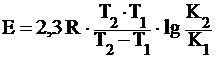 , (3)
, (3)
что позволяет определять энергию активации по измерению скорости реакции при двух различных температурах Т1 и Т2.
Повышение температуры на 100 увеличивает скорость реакции в 2 – 4 раза (приближенное правило Вант-Гоффа). Число, показывающее, во сколько раз увеличивается скорость реакции (следовательно, и константа скорости) при увеличении температуры на 100 называется температурным коэффициентом реакции:
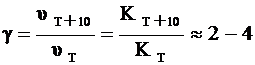 , (4)
, (4)
Или 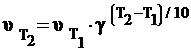 . (5)
. (5)
Это означает, например, что при увеличении температуры на 1000 для условно принятого увеличения средней скорости в 2 раза (g = 2) скорость реакции возрастает в 210, т.е. приблизительно в 1000 раз, а при g = 4 –в 410, т.е. в 1000000 раз. Правило Вант-Гоффа применимо для реакций, протекающих при сравнительно невысоких температурах в узком их интервале. Резкое возрастание скорости реакции при повышении температуры объясняется тем, что число активных молекул при этом возрастает в геометрической прогрессии.
Смотрите также
Роль свободных радикалов в природной среде
Вся
природа, окружающая нас, состоит из химических веществ и их соединений
различной структуры. Их все можно разделить на различные группы по самым
разнообразным признакам: состав, строение ...
Капельный анализ
В современной
аналитической химии наиболее приемлемыми являются методы для выполнения,
которых не требуется сложной аппаратуры и дефицитных затрат реактивов. Так же
важным фактором является ...
Адсорбция
Адсорбция (от лат. ad — на, при и sorbeo — поглощаю), поглощение к.-л. вещества
из газообразной среды или раствора поверхностным слоем жидкости или твёрдого
тела. Например, если поместить в ...


