Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Взаимное влияние атомов в молекуле.Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Органические соединения. / Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Органические соединения. / Взаимное влияние атомов в молекуле. Взаимное влияние атомов в молекуле.
Взаимное влияние атомов можно проследить, сравнивая реакционную способность спиртов, фенолов и органических кислот.
Эти соединения вступают в реакции замещения атома водорода ОН - группы на атом металла о различной легкостью, в зависимости от вида остальной части молекул - радикала.
В спиртах реакция проходит при действии активных щелочных и щелочноземельных металлов, щелочей с образованием фенолятов.
2C6H5OH + 2Na ® 2C6H5ONa + H2О
фенолят натрия
2C6H5OH + NaОН ® 2C6H5ONa + H2О
Гидроксильная группа О-Н влияет в свою очередь на свойства связанных с ней радикалов. Например, фенол в отличие от бензола легко вступает в реакции замещения водорода в ароматическом ядре в орто- и пара- положениях в гидроксильной группе:
Полимеры.
Полимеры - это высокомолекулярные соединения, молекулы которых состоят из большого числа однородных или разнородных мономерных молекул, которые соединяются между собой ковалентными химическими связями.
Несмотря на разнообразие полимеров, для них характерен ряд общих свойств:
1) полимеры в большинстве своем имеют большую молекулярный массу, достигающую порядка 104-105 у. е. Поэтому их молекулы часто называют микромолекулами.
2) Большинство полимеров нелетучи или мало летучи.
3) Полимеры в основном нерастворимы или мало растворимы.
4) Полимеры получаются при помощи реакции полимеризации и поликонденсации.
При реакции полимеризации происходит процесс перестройки связей внутри молекул мономеров без выделения побочных продуктов, без изменения элементарного состава реагирующих веществ, т. е. полимеры, имеют состав, идентичный составу исходного мономера
где n - степень полимеризации, показывает число связанных между собой молекул мономера.
Полимеризация протекает под действием инициаторов, катализаторов, света, тепла и др. факторов.
При получении полимеров методом поликонденсации реакция протекает с выделением побочных низкомолекулярных веществ: воды, хлористого водорода, аммиака и др. Химический состав полимеров отличается от состава исходных мономеров. Только на концах цепей сохраняются функциональные группы из исходных мономеров.
Например, образование поликонденсационной новолачной смолы протекает в присутствии соляной кислоты по следующей схеме:
1) Взаимодействие фенола с формальдегидом в процессе реакции образуется фенолоспирт.
2) Реакция фенолоспирта с фенолом, фенолоспирт содержит метиловую группу CH2 - ОН, которая, реагируя со следующей молекулой фенола, выделяет воду.
Далее продукт конденсации взаимодействует с формальдегидом (согласно пункту 1), образуя фенолоспирт, но уже более сложного строения. Затем идет реакция с фенолом (согласно пункту 2) и т.д. В результате образуется полимер следующего строения:
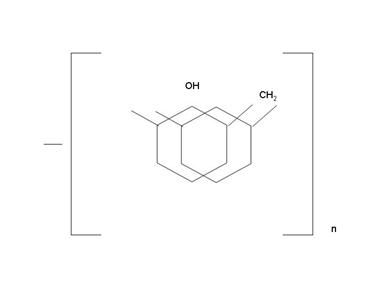
В полученном таким образом полимере макромолекулы имеют линейное строение.
Линейные полимеры являются термопластичными, т.е. при повышении температуры становятся пластичными. При охлаждении полимер переходит в твердое состояние. Такая термообработка может проводится несколько раз.
Если процесс поликонденсации фенола с формальдегидом проводят в присутствии аммиака и формальдегид взят в избытке, то получится термореактивная - резольная смола.
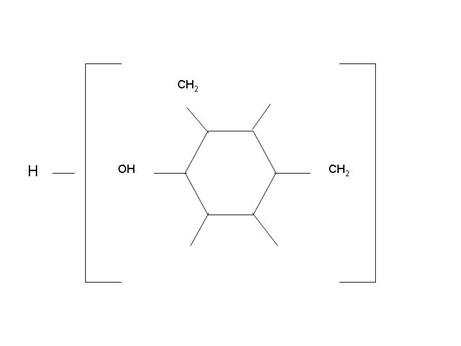
Образовавшиеся вдоль цепей макромолекулы спиртовые группы (в параположении фенола) способны к химическому взаимодействию.
К резольным смолам относятся некоторые линейные и разветвленные полимеры, молекулы которых при нагревании переходят в неплавкое, нерастворимое состояние. При нагревании термореактивный полимер приобретает трехмерное строение, т.е. образуются пространственные сетчатые структуры за счет прочных химических связей. Трехмерные, т.е. сшитые полимеры, не могут переходить в вязко-текучее состояние.
Экспериментальная часть.
Смотрите также
Получение и изучение сульфатов микрокристаллической целлюлозы древесины осины
Сложные эфиры
целлюлозы имеют широкое применение для производства, этим объяснятся большое
количество работ посвященных всестороннему изучению эфиров целлюлозы.
Сернокислые эфиры
(сульфа ...
Геометрия молекул. Теория ЛЭП. Элементы стереохимии
Специалисты
по структурному анализу считают этот раздел стереохимии одинаково важным и
увлекательным и для школьника, и для академика. У этого раздела один “большой
недостаток”.
Он
оди ...
Зелинский Николай Дмитриевич
Есть личности, которые олицетворяют собой динамику развития общества и
определяют поступательное движение общественной жизни на многие годы. Право
стать личностью приобретается умением, буду ...


