Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Отношение металлов к кислороду.Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Общие химические свойства металлов. / Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Общие химические свойства металлов. / Отношение металлов к кислороду. Отношение металлов к кислороду.
Почти все металлы непосредственно взаимодействуют с кислородом, образуя оксиды. Свойства оксидов определяются характером металлов. Оксиды наиболее активных металлов обладают основными свойствами.
Все оксиды делят на три большие группы: основные, кислотные и амфотерные.
Основные оксиды при взаимодействии с ![]() дают основания:
дают основания:
![]()
Кислотные оксиды, образованные металлами, при взаимодействии с ![]() дают кислоты:
дают кислоты:
![]()
Оксиды, проявляющие кислотные и основные свойства, называются амфотерными:
![]()
Отношение металлов к воде.
Обладая, большим отрицательным значением стандартного электродного потенциала щелочные и щелочноземельные металлы при нормальных условиях легко окисляются водой.
![]()
Свойства гидроксидов определяются характером металла. Характер гидроксидов металлов одного периода изменяется от типичных основных через амфотерные соединения к кислотным.
Отношение к щелочам.
В водных растворах щелочей растворяются лишь те металлы, окислительно-восстановительные потенциалы взаимодействия которых с гидроксид ионами более отрицательны, чем потенциал восстановления воды (0,83В) и которые образуют устойчивые анионные гидроксокомплексы. Этим условиям удовлетворяют, например, цинк, алюминий, бериллий:
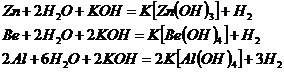
Процесс растворения металла в щелочи многостадиен и включает в себя следующие этапы:
1. Растворение оксидной пленки на поверхности металла:
![]()
2. Растворение металла, освобожденного от пленки в ![]() :
:
![]()
3. Растворение амфотерного гидроксида в щелочи:
![]()
В итоге процессы взаимодействия металла со щелочами можно выразить суммарным уравнением:
![]()
Действие кислот на металлы.
Почти все металлы окисляются кислотами. Этот окислительно-восстановительный процесс зависит как от активности металла, так и от свойств и концентрации кислоты.
Соляная и разбавленная серная кислоты окисляют только те металлы, которые стоят в ряду напряжений до водорода, т.к. роль окислителя в них играют ионы водорода, восстанавливающиеся до свободного водорода, например:
![]()
Концентрированная серная кислота окисляет при нагревании почти все металлы (не окисляется только золото, платина и некоторые редкие металлы). Окислителем является ион ![]() , который в зависимости от активности металла восстанавливается до
, который в зависимости от активности металла восстанавливается до ![]() , свободной серы и даже сероводорода (
, свободной серы и даже сероводорода (![]() ).
).
Азотная кислота, как концентрированная, так и разбавленная окисляет почти все металлы. Окислителем в азотной кислоте является ион ![]() . Концентрированная азотная кислота восстанавливается малоактивными металлами (например,
. Концентрированная азотная кислота восстанавливается малоактивными металлами (например, ![]() ,
, ![]() ) до оксида азота (
) до оксида азота (![]() ), а более активными металлами (например, Fe, Zn, Mg) до -
), а более активными металлами (например, Fe, Zn, Mg) до - ![]() . Алюминий, железо, хром при действии на них концентрированной азотной кислоты «пассивируются». Покрываясь, тонкой пленкой оксида они перестают после этого подвергаться действию не только концентрированных, но и разбавленных кислот.
. Алюминий, железо, хром при действии на них концентрированной азотной кислоты «пассивируются». Покрываясь, тонкой пленкой оксида они перестают после этого подвергаться действию не только концентрированных, но и разбавленных кислот.
Смотрите также
Разработка технологии полимеризационного наполнения ПКА дисперсными наполнителями
В
настоящее время рынок потребления высоконаполненных композиционных
магнитотвёрдых материалов, к которым относятся так называемые магнитопласты,
является одним из самых динамичных в промыш ...
Конструирование биосенсора для регистрации P. aeruginosa АТСС 27853
Регистрация патогенных
микроорганизмов в растворах электролитов является одним из основных заданий
медицины, биохимии и электрохимического анализа. С этой целью в мире
разрабатываются биосе ...
Выводы
Методом линейной
циклической вольтамперометрии исследовано совместное восстановление ионов
гадолиния и алюминия в хлоридных и хлоридно-фторидных расплавах на серебряном и
платиновом электродах.
...


