Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Реакции обмена.Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Гидролиз солей. / Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Гидролиз солей. / Реакции обмена. Реакции обмена.
Обязательным условием течения реакций между электролитами является удаление из раствора тех или иных ионов - например, вследствие образования слабо диссоциирующих веществ, или веществ, выделяющихся из раствора в виде осадка или газа. Иначе говоря, реакции в растворах электролитов всегда идут в сторону образования наименее растворимых веществ.
Уравнения реакций в таких случаях рекомендуется записывать в молекулярно-ионной форме, которая позволяет лучше понять сущность протекающих процессов. В молекулярно-ионных уравнениях сильные электролит пишутся в виде ионов, а слабые электролиты, трудно растворимые вещества - в виде молекул.
Существует четыре случая обменных реакций в растворах электролитов, равновесие которых сильно смещено в сторону образования продуктов реакции:
1. Реакции, идущие с образованием осадка.
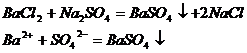
2. Реакции, сопровождающиеся образованием газообразных (летучих) веществ.
![]()
3. Реакции, протекающие с, образованием слабых электролитов.
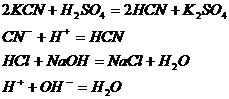
4. Реакции, идущие с образованием комплексных ионов.
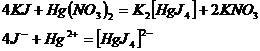
Смотрите также
Технология получения и свойства мочевино-формальдегидных смол
Первые
продукты конденсации мочевины с формальдегидом (карбамидные смолы) были
получены еще в 1896 г., но производство мочевино-альдегидных смол налажено лишь
в 1920—1921 гг.
Мочевино-фо ...
Синтез и исследование комплексов рения (IV) с некоторыми аминокислотами
Предложены методы
синтеза комплексных соединений рения (IV) c некоторыми аминокислотами состава [К(LH)][ReХ6], (LH)2[ReХ6] и [ReL2Х4]H2O (L’–глицин-NH2-CH2-COOH; L-лейцин-((CH3 )2-CH-CH2-CH(N ...
Д. И. Менделеев
Свою мини творческую работу я хотел
бы начать с причин, которые подтолкнули меня к её написанию.
Во-первых, до написания этой работы я
знал о Дмитрии Ивановиче только то, что он был Велик ...


