Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Химия гидросферыОткрытая химия / Химия окружающей среды / Открытая химия / Химия окружающей среды / Химия гидросферы Химия гидросферыСтраница 1
Особенности гидросферы определяются особенностями воды: ее физические свойства обусловлены химическим строением.
Вода H2O на 99,73 % состоит из 1H216O, но в природе встречается еще дейтерий (стабилен) 2D и тритий (3T, –β), а если принять во внимание, что кроме 16O есть еще 17O и 18O, то в природе встречается девять разновидностей воды.
Жидкая вода имеет максимальную плотность при 4 °С (принята за единицу), а переход в твердое состояние, сопровождающийся изменением упаковки молекул, понижает плотность до 0,9. Это обстоятельство (лед плавает) и малая теплопроводность льда во многом способствуют стабилизации процессов в гидросфере.
 |
|
Рисунок 10.6 Большую часть Земли покрывает вода |
Все свойства воды обусловлены наличием двух неподеленных электронных пар у атома кислорода, атомные орбитали которого гибридизированы по sp3-типу, и способностью атомов водорода соседних молекул образовывать с этими неподеленными электронными парами достаточно прочные водородные связи. В результате как жидкая, так и кристаллическая вода (лед) оказываются хорошо структурированными, хотя число локальных нарушений дальнего порядка при плавлении возрастает.
Экспериментально установлено, что протон в воде может быть только гидратированным. Гидратация не исчерпывается реакцией H+ + H2O = H3O+. Последовательно может присоединиться несколько молекул воды:
|
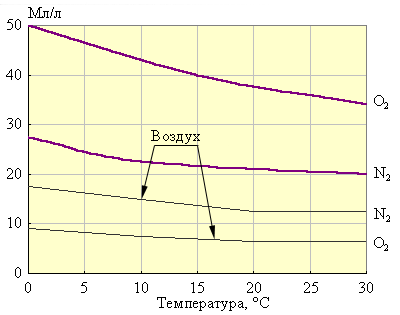
Исходя из постоянства произведения ионов H+ и OH–, образующихся при диссоциации H2O = H+ + OH–, важнейшим критерием поддержания жизнеспособности условий в воде и почве является узкий интервал изменений водородного показателя (pH) в пределах 6–9. В природной воде прежде всего растворяются газы атмосферы: O2, N2 (рис. 10.7) и CO2.
 |
|
Рисунок 10.7 Растворимость N2 и O2 воздуха и чистых азота и кислорода при атмосферном давлении. |
Хотя растворимость кислорода в два раза больше растворимости азота, но из-за большего парциального давления (78 %) в природной (дождевой) воде азота растворено в два раза больше, чем кислорода. Минерализация воды приводит к уменьшению растворимости воздуха. Так, при 0 °С растворимость кислорода (чистого) составляет 49 мл/л, а морской воде только 15 мл/л. Необходимое для окисления растворимых в воде веществ количество кислорода называется биохимической потребностью в кислороде (БПК).
Так, чистая вода, вытекающая из-под ледников, имеет БПК < 1 млн–1, пригодная для питья – < 5 млн–1, а канализационная – 100–500 млн–1.
Большую проблему создают попадающие в водоемы нитраты и фосфаты, поскольку они при неумелом использовании вызывают заболевание малопроточных водоемов и прудов.
Растворение CO2 в воде сопровождается химическим взаимодействием с установлением равновесия:
|
K1 = 4,5 · 10–7, K2 = 5,6 · 10–11.
Обычные методы измерения констант диссоциации не позволяют отличить растворенный CO2 от H2CO3 в растворе. Так как равновесие устанавливается быстро, то за контанту равновесия этой реакции Kравн = [H2CO3] / [CO2]∙[H2O] обычно принимают первую константу диссоциации угольной кислоты (K1 = 4,5 · 10–7). Вместе с тем найдено, что H2CO3 / CO2 = 0,0037; это означает, что только 0,37 % растворенного CO2 находится в виде H2CO3. Если бы весь растворенный CO2 находился в виде H2CO3, то K1 = 1,8 · 10–4, что позволяет отнести H2CO3 к умеренно сильным кислотам. Практически из-за быстрого установления равновесия гидратации CO2 приходится пользоваться не действительной константой диссоциации K1 = 1,8 · 10–4, а кажущейся K1 = [H+]∙[H2CO3] / CO2 = 4,5 ∙ 10–7, относящейся к реакции CO2 ∙ H2O = H+ + HCO3–.
Смотрите также
Процессы и аппараты химической технологии
В данной работе стоит задача спроектировать
установку для выпаривания раствора хлорида аммония.
Выпаривание – это
процесс концентрирования растворов твердых нелетучих веществ путем части ...
Поливинилацетат (ПВА)
Среди изобилия
самых разнообразных по строению и свойствам органических соединений есть особый
класс - полимеры (от греч. «поли» - «много» и «мерос» - «часть»). Для этих
веществ, прежде все ...


