Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Теория поля лигандовОткрытая химия / Координационные соединения / Открытая химия / Координационные соединения / Теория поля лигандов Теория поля лигандов
Метод молекулярных орбиталей применительно к координационным соединениям позволяет более строго описать их электронное строение и называется теорией поля лигандов (ТПЛ).
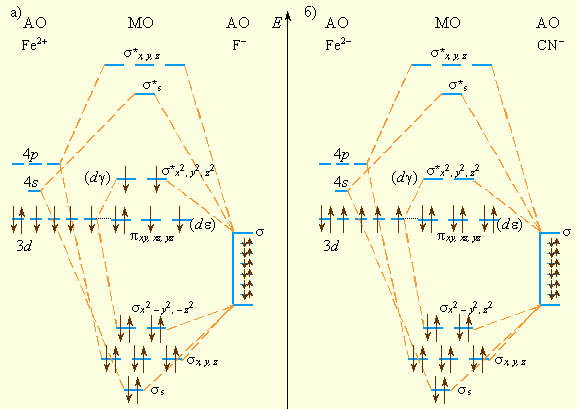
Рассмотрим октаэдрический комплекс [ML6]n–, в котором каждый ион L– способен образовать только одну σ-связь с центральным атомом. Шесть σ-орбиталей лигандов объединяются в шесть групповых орбиталей, каждая из которых может перекрываться только с одной из шести АО металла, направленных к вершинам октаэдра: dx²–y², dz², px, py, pz и s. Каждое попарное перекрывание приводит к образованию одной связывающей и одной разрыхляющей МО. Орбитали dxy, dxz, dyz (dε) не направлены к вершинам октаэдра, поэтому они не могут участвовать в образовании σ-МО и остаются несвязывающими (рис. 9.6).
Электронные пары лигандов занимают связывающие МО, а d-электроны могут занять несвязывающие (π) и разрыхляющие σ*-орбитали.
 |
|
Рисунок 9.6 Схемы МО октаэдрических комплексов: высокоспинового [FeF6]4– (a)и низкоспинового [Fe(CN)6]4– (б) |
В отличие от ТКП здесь более обоснована стабильность комплексного иона, определяющаяся, главным образом, энергией образования шести двухэлектронных связей. Разность между несвязывающими π-МО и разрыхляющими σ*-МО соответствуют параметру расщепления Δ. На этих пяти орбиталях размещаются d-электроны комплексообразователя, причем в зависимости от величины параметра расщепления Δ возникают как высокоспиновые комплексы – [FeF6]4–(π)4(σ*)2, так и низкоспиновые – [Fe(CN)6]4–(π)6.
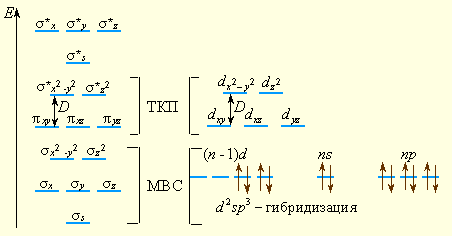
В рамки ММО укладываются и ТКП (расщепление d-орбиталей на dε и dγ), и МВС, поскольку связывающие орбитали уже не являются чистыми орбиталями лигандов, а принадлежат и центральному атому (рис. 9.7).
 |
|
Рисунок 9.7 Сопоставление ММО, МВС и ТКП применительно к октаэдрическому комплексу d-элемента |
Смотрите также
Определение уроновых кислот и полиуронидов
В состав кислых полисахаридов и полиуронидов древесины
входят звенья двух гексуроновых кислот — D-глюкуроновой
и D-галактуроновой. Звенья D-глюкуроновой
кислоты преимущественно содержатся в ...
Получение алкилсиланов взаимодействием металлоорганических соединений с алкилхлорсиланами
Технический
прогресс в значительной степени зависит от использования новых материалов и
технологий. Поэтому в последнее время в промышленно развитых странах стали
уделять все больше внимани ...


