Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Билет №5. (углубленный)Статьи и работы по химии / Билеты по химии 10 класс / Статьи и работы по химии / Билеты по химии 10 класс / Билет №5. (углубленный) Билет №5. (углубленный)Страница 2
Степень электролитической диссоциации a – число, показывающее, какая часть молекул электролита находится в растворе в виде ионов.
Согласно этому определению
![]()
Очевидно, во всех растворах неэлектролитов, где диссоциация на ионы полностью отсутствует, a=0, а в растворах, в которых все растворенное вещество присутствует в форме ионов (полная диссоциация), a=1. Очень часто для растворов средней и высокой концентраций (с»5,0% .с»10,0%) считают, что слабые электролиты характеризуются a£0,03, а сильные – a³0,30. Электролиты средней силы характеризуются промежуточными значениями степени диссоциации: 0,03£a£0,30. Однако необходимо отметить, что предложенная классификация является в значительной степени условной (особенно в случае слабых электролитов и электролитов средней силы). Это объясняется следующим. Степень диссоциации в общем случае зависит от природы электролита и растворителя, от концентрации и температуры раствора. Для растворов, образованных одними и теми же компонентами (растворителем и растворенным веществом), наибольший интерес представляет зависимость степени диссоциации от концентрации раствора. Для слабых электролитов типа H+B– (кислота) или А+ОН– (основание) степень диссоциации ос и концентрация раствора с связаны зависимостью:
![]()
где Кi — константа, характеризующая способность того или иного слабого электролита к диссоциации.
При малых значениях a (a£0,05) разность 1–a приблизительно равна 1. Тогда из этого уравнения можно получить:
![]()
что является математическим выражением закона разведения Оствальда: степень диссоциации слабого электролита в растворе тем выше, чем более разбавлен раствор.
Допустим, что при растворении электролита ВА в воде образуется раствор, имеющий концентрацию с. В результате некоторая часть а электролита ВА диссоциирует, образуя ионы B+ и А–. Величина a называется степенью диссоциации. Равновесная концентрация неионизированного электролита ВА оказывается равной с(1– a). Таким образом, можно записать
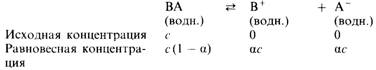
Запишем теперь выражение для константы равновесия рассматриваемой диссоциации
![]()
Подставив в это выражение равновесные концентрации участников диссоциации, получим
![]()
Это соотношение и представляет собой закон разбавления Оствальда. Константа Кс называется константой диссоциации электролита. Чем больше Kc, тем сильнее электролит.
Смотрите также
Фосфор и его соединения
Пятая группа Периодической системы включает два типических элемента азот
и фосфор – и подгруппы мышьяка и ванадия. Между первым и вторым типическими
элементами наблюдается значительное раз ...
Исследование электрохимического поведения ионов самария в хлоридных и хлоридно-фторидных расплавах
...


