Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Билет №2Статьи и работы по химии / Билеты по химии 10 класс / Статьи и работы по химии / Билеты по химии 10 класс / Билет №2 Билет №2
Строение атомов химических элементов на примере элементов второго периода и IV-A группы периодической системы химических элементов Д. И. Менделеева. Закономерности в изменении свойств этих химических элементов и образованных ими простых и сложных веществ (оксидов, гидроксидов) в зависимости от строения их атомов.
При перемещении слева направо вдоль периода металлические свойства элементов становятся все менее ярко выраженными. При перемещении сверху вниз в пределах одной группы элементы, наоборот, обнаруживают все более ярко выраженные металлические свойства. Элементы, расположенные в средней части коротких периодов (2-й и 3-й периоды), как правило, имеют каркасную ковалентнуто структуру, а элементы из правой части этих периодов существуют в виде простых ковалентных молекул.
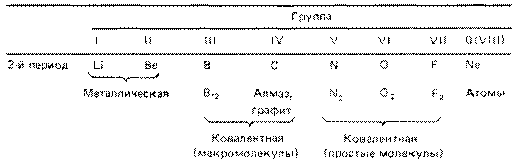
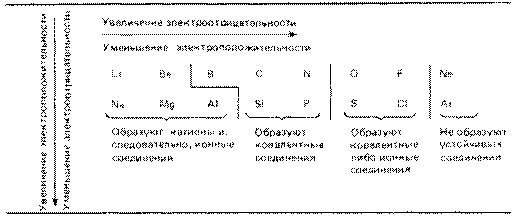
Атомные радиусы изменяются следующим образом: уменьшаются при перемещении слева направо вдоль периода; увеличиваются при перемещении сверху вниз вдоль группы. При перемещении слева направо по периоду возрастает электроотрицательность, энергия ионизации и сродство к электрону, которые достигают максимума у галогенов. У благородных же газов электроотрицательность равна 0. Изменение сродства к электрону элементов при перемещении сверху вниз вдоль группы не столь характерны, но при этом уменьшается электроотрицательность элементов.
В элементах второго периода заполняются 2s, а затем 2р-орбитали.
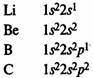
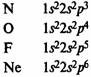
Главная подгруппа IV группы периодической системы химических элементов Д. М. Менделеева содержит углерод С, кремний Si, германий Ge, олово Sn и свинец Pb. Внешний электронный слой этих элементов содержит 4 электрона (конфигурация s2p2). Поэтому элементы подгруппы углерода должны иметь некоторые черты сходства. В частности, их высшая степень окисления одинакова и равна +4.
А чем обусловлено различие в свойствах элементов подгруппы? Различием энергии ионизации и радиуса их атомов. С увеличением атомного номера свойства элементов закономерно изменяются. Так, углерод и кремний — типичные неметаллы, олово и свинец — металлы. Это проявляется прежде всего в том, что углерод образует простое вещество-неметалл (алмаз), а свинец типичный металл.
Германий занимает промежуточное положение. Согласно строению электронной оболочки атома p-элементы IV группы имеют четные степени окисления: +4, +2, – 4. Формула простейших водородных соединений — ЭН4, причем связи Э—Н ковалентны и равноценны вследствие гибридизации s- и р- орбиталей с образованием направленных под тетраэдрическими углами sp3 -орбиталей.
Ослабление признаков неметаллического элемента означает, что в подгруппе (С—Si—Ge—Sn—Pb) высшая положительная степень окисления +4 становится все менее характерной, а более типичной становится степень окисления +2. Так, если для углерода наиболее устойчивы соединения, в которых он имеет степень окисления +4, то для свинца устойчивы соединения, в которых он проявляет степень окисления +2.
А что можно сказать об устойчивости соединений элементов в отрицательной степени окисления —4? По сравнению с неметаллическими элементами VII—V групп признаки неметаллического элемента р-элементы IV группы проявляют в меньшей степени. Поэтому для элементов подгруппы углерода отрицательная степень окисления нетипична.
Смотрите также
Гетерогенный катализ
Гомогенно-каталитизируемое
превращение протекает в одной фазе, где смешаны и реагенты, и катализатор, и
продукты. В гетерогенно-катализируемом превращении катализа-тор образует
отдельную фа ...
Жидкие кристаллы
Некоторое время
тому назад необычной популярностью в США пользовалась новинка ювелирного
производства, получившая название “перстень настроения”. За год было продано 5 0 миллионов таких ...


