Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Обсуждение результатов. Исследование гетерогенных катализаторов
амидирования м-толуиловой кислоты. Термодинамика процессаДипломы, курсовые и прочее / Выбор катализатора амидирования и изучение в его присутствии превращения м-толуиловой кислоты в N,N-диэтил-м-толуамид / Дипломы, курсовые и прочее / Выбор катализатора амидирования и изучение в его присутствии превращения м-толуиловой кислоты в N,N-диэтил-м-толуамид / Обсуждение результатов. Исследование гетерогенных катализаторов
амидирования м-толуиловой кислоты. Термодинамика процесса Обсуждение результатов. Исследование гетерогенных катализаторов
амидирования м-толуиловой кислоты. Термодинамика процесса
Поскольку реакция амидирования м-толуиловой кислоты (МТК) является обратимой, на первом этапе исследований были изучены термодинамические характеристики процесса. С целью определения состава равновесной смеси и условий, при которых могут быть сняты термодинамические ограничения, на первых порах был проведен расчет констант равновесия при различных температурах в диапазоне 260-320°С для реакции (табл. 3.1).
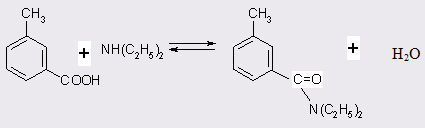
толуамид катализатор кислота токсикологический
Расчет констант равновесия проводился по экспериментальным данным после достижения в статических условиях устойчивых равновесных концентраций компонент [51]. В качестве катализатора реакции в данном случае использовали 0,5 мас.% хлорной кислоты. Достижение равновесия при любых температурах определялось только с одной стороны (опыты по гидролизу диэтилтолуамида не проводились).
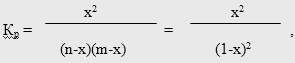
где х - степень превращения МТК или ее мольная доля [52]; n и m - мольные доли исходных компонентов (для простоты принято, что n = m = 1).
Обработка полученных значений Кр по методу наименьших квадратов [53] позволила аппроксимировать их следующим эмпирическим уравнением:
Кр = exp(8,81 – 3019,25/Т),
которое, в частности, может быть использовано при синтезе химико-технологических систем на стадии проектирования.
Расчет термодинамически возможной степени превращения при различных температурах и мольных отношениях реагентов осуществлялся по формуле [51]
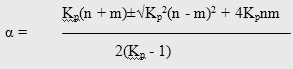
Таблица 3.1 Расчетные значения констант равновесия и термодинамически возможные степени превращения м-толуиловой кислоты при различных условиях синтеза м-ДЭТА
|
t, 0С |
К |
Соотношение МТК:диэтиламин |
Кр |
Степень превращения МТК (α) |
|
260 |
533 |
1:1 1:5 |
21,49 |
0,549 0,880 |
|
280 |
553 |
1:1 1:2 1:5 |
27,96 |
0,840 0,967 0,990 |
|
300 |
573 |
1:1 1:3 1:5 |
36,00 |
0,857 0,986 0,990 |
|
320 |
593 |
1:1 1:2 1:3 1:5 |
40,35 |
0,860 0,970 0,988 0,990 |
Анализ данных, представленных в табл. 3.1, позволяет сделать вывод, что при соотношении МТК: диэтиламин 1:1 мольн. и при 2600С термодинамически возможная степень превращения составляет 0,55, а при 320 0С - 0,86. При температуре 280 0С и мольном соотношении реагентов 1:2 термодинамические ограничения практически снимаются.
Отметим, что небольшие значения констант равновесия свидетельствуют о том, что, несмотря на снятие термодинамических ограничений, реакция по-прежнему остается равновесной. Поэтому дальнейшее увеличение концентрации диэтиламина и повышение температуры максимально благоприятствуют процессу.
Следующей важной характеристикой процесса является тепловой эффект реакции, который из-за отсутствия в литературе термодинамических характеристик исходных и конечных компонент (кроме диэтиламина и воды) был оценен по теплотам сгорания органических соединений в газообразном состоянии, и его величина составила ΔНо298= -20±5 кДж/моль. В свою очередь теплоты сгорания веществ, принимающих участие в реакции, рассчитаны по формуле [54]:
ΔНсгор= - (204,2n + 44,4m + Σх),
где n - число атомов кислорода, необходимое для полного сгорания вещества; m - число молей образующейся воды; х - поправка (термическая характеристика), постоянная в пределах гомологического ряда.
Термическая характеристика (х) - это фактически инкремент численных значений группы атомов или типа связи. Так, например, для МТК х = 100,4 кДж/моль [54]. Таким образом, выполненный термодинамический расчет показал возможность количественного превращения м-толуиловой кислоты в м-ДЭТА и позволил определить область режимов проведения реакции, соответствующих достижению поставленной цели.
Смотрите также
Введение
Колебательные процессы играют существенную роль в
жизнедеятельности различных организмов, определяя основной механизм многих
явлений биологической подвижности (летательные мышцы насекомых, биение се ...
Исследования химии в 20-21 веках
На рубеже тысячелетий в каждой из главных
областей естествознания – биологии, физике, химии - произошли и происходят
одинаково важные, капитальные, но притом различные метаморфозы.
Бурно ...


